
 ②0.1mol/L
②0.1mol/L ③0.1mol/L
③0.1mol/L
 和0.1mol/L
和0.1mol/L 混合液 ⑤0.1mol/L
混合液 ⑤0.1mol/L
 最小的是 ;
最小的是 ; 最小的是 (填序号)
最小的是 (填序号) 的大小关系是② ③(填“>”、“<”或“=”)
的大小关系是② ③(填“>”、“<”或“=”) 和 离子的物质的量浓度之和为0.2mol/L。
和 离子的物质的量浓度之和为0.2mol/L。 ,则说明
,则说明 的水解程度 (填“>”、“<”或“=”)
的水解程度 (填“>”、“<”或“=”) 的水解程度,
的水解程度, 与
与 浓度的大小关系是:
浓度的大小关系是:
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)科目:高中化学 来源:不详 题型:单选题
| A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+) |
| B.Va=Vb时:c(CH3COOH)+c(H+)=c(OH-) |
| C.Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+) |
| D.Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 mol·L-1
mol·L-1查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.点①所示溶液中:[CH3COO-]+[OH-]=[CH3COOH]+[H+] |
| B.点②所示溶液中:[Na+]=[CH3COOH]+[CH3COO-] |
| C.点③所示溶液中:[Na+]>[OH-]>[CH3COO-]>[H+] |
| D.滴定过程中可能出现: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
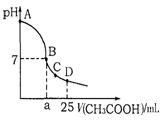
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(CH3COO-)= c(Na+)时,醋酸与氢氧化钠恰好完全中和 |
| B.c(CH3COO-)> c(Na+)> c(H+)> c(OH-)时,不一定是醋酸过量 |
| C.c(Na+)> c(CH3COO-)> c(OH-)> c(H+)时,一定是氢氧化钠过量 |
| D.c(CH3COO-)= c(Na+)时,该溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.滴定终点时:溶液的pH=7 |
B.滴定终点时:c(K+) = c(CH3COO- ),c(H+) < c(OH-) ),c(H+) < c(OH-) |
C.当溶液pH=7时:c(K+) =  c(CH3COO-) + c c(CH3COO-) + c (CH3COOH) (CH3COOH) |
| D.接近滴定终点时:c(K+) + c(H+) = c(CH3COO-) + c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com