
| A�� | �����������������Na2O2���������������ǻ�ԭ�� | |
| B�� | ��Ӧ����������ֻ������ | |
| C�� | ����Ӧ������״����2.24 L O2 ʱ����Ӧת�Ƶĵ���Ϊ0.1mol | |
| D�� | ͨ����˵���ữ�ĸ��������Һ��ָ�μ���Ũ����ĸ��������Һ |
���� �÷�Ӧ��MnԪ�ػ��ϼ���+7�۱�Ϊ+2�ۡ�OԪ�ػ��ϼ���-1�۱�Ϊ0�ۣ�����MnO4-����������Na2O2�ǻ�ԭ��������������ת�Ƶ���֮��Ĺ�ϵʽ���㣮
��� �⣺A���÷�Ӧ��MnԪ�ػ��ϼ���+7�۱�Ϊ+2�ۡ�OԪ�ػ��ϼ���-1�۱�Ϊ0�ۣ�����MnO4-����������Na2O2�ǻ�ԭ������A����
B�����������ǻ�ԭ������������������������B��ȷ��
C�����ɱ����2.24L����ʱ��ת�Ƶ��ӵ����ʵ���=$\frac{2.24L}{22.4L/mol}$��2=0.2mol����C����
D���������������Ũ�����������������Բ��ܽ�Ũ���������������Һ�У�Ӧ����ϡ���ᣬ��D����
��ѡB��
���� ���⿼��������ԭ��Ӧ����Ŀ�ѶȲ����ؿ���ѧ���Ի�������������۵ķ������ע�������ص�ǿ�����ԣ��״�ѡ����D��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ʱ����Na2O2��H2O2����Ӧ��ѡ����ͬ�����巢��װ�� | |
| B�� | ������ʱ���ñ���NaHCO3��Һ��Ũ���Ά���������� | |
| C�� | ������ʱ����Ũ������п��Ӧ����ϡ����� | |
| D�� | �ƶ�������ʱ����ˮ��NaOH��Һ����β�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ռ���Һʢװ�ڴ����������Լ�ƿ�� | |
| B�� | ���������Ʊ�����ú���� | |
| C�� | ����ɫʯ����Һ�м���������ˮ��ʯ����Һ�ȱ�����ɫ | |
| D�� | ���ά�����ò���Ϊ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol Na2O2�����к��е���������ĿΪ2NA | |
| B�� | 1 mol Na2O2������CO2��Ӧʱ��ת��2NA������ | |
| C�� | 1 mol•L-1��NaOH��Һ�к�Na+��ĿΪNA | |
| D�� | 1 mol��������������Ӧ����Na2O��Na2O2ʱ��ʧ������Ŀ��ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | A+B�TC+D | B�� | 2A+B�T2C+D | C�� | A+B�T2C+D | D�� | 2A+B�TC+2D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
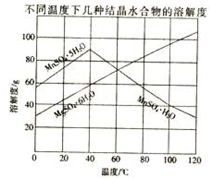 ���̿���Ҫ�ɷ�MnO2�����ʽ���Ԫ��Fe��Al��Mg�ȣ���ˮ����Һ��������SO2��Ӧ���Ʊ�MnSO4•H2O����Ӧ�Ļ�ѧ����ʽΪ��MnO2+SO2=MnSO4
���̿���Ҫ�ɷ�MnO2�����ʽ���Ԫ��Fe��Al��Mg�ȣ���ˮ����Һ��������SO2��Ӧ���Ʊ�MnSO4•H2O����Ӧ�Ļ�ѧ����ʽΪ��MnO2+SO2=MnSO4�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
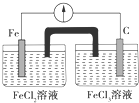
| A�� | Fe�Ǹ�����C������ | B�� | ������Ӧʽ��Fe-3e-�TFe3+ | ||
| C�� | �ڵ�·������������FeCl2��Һ | D�� | ������ʯī�缫����Fe�缫 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com