

 CO2(g)+H2(g)
CO2(g)+H2(g) =1,x≈0.667,所以一氧化碳的转化率:
=1,x≈0.667,所以一氧化碳的转化率: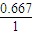 ×100%=66.7%,
×100%=66.7%, ×100≈22.2%,
×100≈22.2%,

科目:高中化学 来源: 题型:
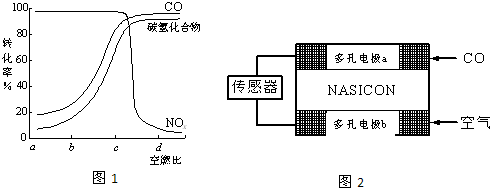
 (2011?南京二模)三效催化转化器可减少汽车尾气中的主要污染物(CO、NOx等),部分反应如下:
(2011?南京二模)三效催化转化器可减少汽车尾气中的主要污染物(CO、NOx等),部分反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:江苏省南京市白下区2011届高三二模化学试题 题型:022
三效催化转化器可减少汽车尾气中的主要污染物(CO、NOx等),部分反应如下:
①2NO(g)+2CO(g)=N2(g)+2CO2(g) ②CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g)
(1)
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol-12C(s)
十O2(g)=2CO(g) ΔH=-221.0 kJ·mol-1C(s)
十O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1则反应①的ΔH=________.
(2)已知某温度下,反应②的平衡常数K=1.0.在该温度下向某密闭容器中充入1.0 mol CO和2.0 mol H2O,经充分反应达平衡后,CO的平衡转化率为________,H2的体积分数为________.
(3)NaBH4/H2O2燃料电池是一种有广泛前景的汽车能源,结构如图所示.电池工作时,负极发生的电极反应可表示为________.
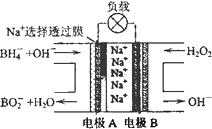
查看答案和解析>>
科目:高中化学 来源:江苏模拟题 题型:填空题
 H2(g)+CO2(g)
H2(g)+CO2(g)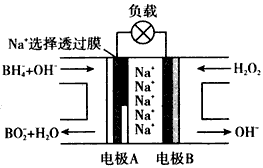
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com