
����Ŀ������ȱ��͵������������Խ������Σ����Ŀǰ�ӵ�ʳ���е�Ԫ�ؾ�����IO3�����ڣ�������I�����ڡ���ʹ��Na2S2O3��ij������Ʒ�е�Ԫ�صĺ������вⶨ��
I��I���Ķ��Լ��
��1��ȡ����������Ʒ���Թ��У���ˮ�ܽ⡣�μ������ữ���ٵμ�����5%NaNO2�͵��۵Ļ����Һ������Һ��ɫ�������I����ͬʱ��������ɫ���������������Ϊ����ɫ����д���÷�Ӧ�����ӷ���ʽΪ_____________��
������������Ƶ��Ʊ�
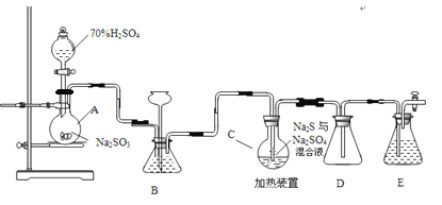
��ѧʵ���ҿ�������װ�ã���ȥ���ּӳ��������Ʊ�Na2S2O35H2O����ƿC�з�����Ӧ���£�
Na2S��aq��+H2O��l��+SO2��g��=Na2SO3��aq��+H2S��aq�� ��I��
2H2S��aq��+SO2��g��=3S��s��+2H2O��l�� ��II��
S��s��+Na2SO3��aq��![]() Na2S2O3��aq�� ��III��
Na2S2O3��aq�� ��III��
��2��������װ��ɺر����˻�������װ��B�еij���©����ע��Һ�����γ�һ��Һ������_____________��������װ�����������á�װ��D��������_____________ ��װ��E��Ϊ_____________��Һ��
��3��Ϊ��߲�Ʒ���ȣ�Ӧʹ��ƿC��Na2S��Na2SO3ǡ����ȫ��Ӧ������ƿC��Na2S��Na2SO3���ʵ���֮��Ϊ_____________��
��4��װ��B������֮һ�ǹ۲�SO2���������ʣ����е�Һ�����ѡ��____________��
a������ˮ b������Na2SO3��Һ
c������NaHSO3��Һ d������NaHCO3��Һ
ʵ���У�ΪʹSO2����������ƿC�����õIJ�����_____________����֪��Ӧ��III����Խ���������ƿC�з�Ӧ�ﵽ�յ������__________________��
��5����Ӧ��ֹ����ƿC�е���Һ������Ũ����������Na2S2O35H2O�����п��ܺ���Na2SO3��Na2SO4�����ʡ����������Լ����ʵ�飬����Ʒ���Ƿ����Na2SO4����Ҫ˵��ʵ�����____________������ͽ���_________����
��֪Na2S2O35H2O�����ֽ⣺S2O32+2H+=S��+SO2��+H2O
��ѡ����Լ���ϡ���ᡢϡ���ᡢϡ���ᡢBaCl2��Һ��AgNO3��Һ
�����⺬���IJⶨ
��֪������ȡ10.00g������Ʒ������250mL��ƿ�У���ˮ100mL�ܽ⣬��2mL���ᣬҡ�ȡ�
���μӱ�����ˮ����Һ����dz��ɫ���ߵμӱ�ҡ������ɫ����ȥΪֹ��Լ1mL����
��������У���ȥ�������壬�ټ������5min��������ȴ����������15%�⻯����Һ��ҡ�ȡ�
����������������Һ��ָʾ��������0.002mol/L��Na2S2O3����Һ�ζ����յ㡣
���ظ����Σ�ƽ������Na2S2O3��Һ9.00mL
��ط�ӦΪ��I����3Br2��3H2O = IO3����6H+��6Br����IO3����5I����6H+ = 3I2��3H2O��I2+2S2O32��= 2I����S4O62��
��6��������������ݼ���õ��κ�����Ϊ_______________mg��kg��1��
���𰸡��� 2 I��+2 NO2��+ 4 H+ = I2 + 2 NO�� + 2 H2O Һ���߶ȱ��ֲ��� ��ֹ���� NaOH 2:1 c ���Ƶμ�������ٶ� ��Һ����壨�������ʧ��ɫ������ʧ�� ȡ������Ʒ��������ϡ���ᣬ���ã�ȡ�ϲ���Һ������ˣ�ȡ��Һ�����μ�BaCl2��Һ�������ֳ�����˵������Na2SO4���� 38.1��
��������
��1����������������֪�������ữ��NaNO2��������������I-����Ϊʹ���۱�����I2����������ԭΪ��ɫ����NO���仯ѧ����ʽΪ��2I-+2NO2-+4H+=I2+2NO��+2H2O��
��2��������װ��ɺر����˻�������װ��B�еij���©����ע��Һ�����γ�һ��Һ������Һ���߶ȱ��ֲ��䣬������װ�����������á���ʵ��װ�ýṹ��������֪װ��DΪ��ȫƿ����ֹ������װ��E��ΪNaOH��Һ�����ն���Ķ�������ֹ��Ⱦ������
��3��������Ŀ����3����Ӧ���ɵó���Ӧ��ϵ��2Na2S��2H2S��3S��3 Na2SO3��2Na2S��Ӧʱͬʱ����2Na2SO3������ҪNa2SO3��������ƿC��Na2S��Na2SO3���ʵ���֮��Ϊ2��1��
��4���۲�SO2���������ʣ�����ǿ����ȡ����ķ�Ӧ��a�����ɶ�������bd�����ʾ����������Ӧ��ֻ��c�б���NaHSO3��Һ�ʺ���ȡ��������
��ѡc��
ʵ���У�ΪʹSO2����������ƿC�����õIJ����ǿ��Ƶμ�������ٶȣ�
���з���S��g��+Na2SO3��aq��![]() Na2S2O3��aq������Ӧ�ﵽ�յ���S��ȫ�ܽ⣬�ɹ۲쵽��Һ����壨�������ʧ��ɫ������ʧ����
Na2S2O3��aq������Ӧ�ﵽ�յ���S��ȫ�ܽ⣬�ɹ۲쵽��Һ����壨�������ʧ��ɫ������ʧ����
��5������Ʒ���Ƿ����Na2SO4������������ͽ���Ϊȡ������Ʒ��������ϡ���ᣬ���ã�ȡ�ϲ���Һ������ˣ�ȡ��Һ�������뼸��BaCl2��Һ����������ɫ������˵����Ʒ�к���Na2SO4����û�в�����ɫ������˵����Ʒ�в���Na2SO4��
��6���������ṩ�ķ���ʽ�п�֪��ϵʽΪ��I-![]() IO3-
IO3-![]() 3I2
3I2![]() 6S2O32�����躬��Ԫ�����ʵ���Ϊx��I-
6S2O32�����躬��Ԫ�����ʵ���Ϊx��I-![]() IO3-
IO3-![]() 3I2
3I2![]() 6S2O32��
6S2O32��
1 6
x 0.002mol/L��0.009L
���x =![]() = 3.0��10��6 mol����������Ԫ�ص�����Ϊ3.0��10��6 mol��127 g/mol = 3.81��10��1 mg�����Ըüӵ�����Ʒ�е�Ԫ�صĺ���Ϊ(3.81��10��1 mg)/0.01 kg = 38.1 mg��kg��1��
= 3.0��10��6 mol����������Ԫ�ص�����Ϊ3.0��10��6 mol��127 g/mol = 3.81��10��1 mg�����Ըüӵ�����Ʒ�е�Ԫ�صĺ���Ϊ(3.81��10��1 mg)/0.01 kg = 38.1 mg��kg��1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������л��������빦�ܹ�ϵͼ���й������������

A. С������ϸ���У�����A�������ǣ�����E�ǵ���
B. ��ͬ������E��F���������ֽ⣬�ͷ������϶����F
C. ����C������Լ��20�֣��������Ԫ����C��H��O��N
D. SARS����������H����ˮ�������CO2��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ��ȼ�ϵ�����������ȼ�ϵ�ؾ������С���ŵ㣮һ����Һ̬�£�N2H4��Ϊȼ�ϵĵ��װ����ͼ��ʾ���õ���ÿ����е�������Ϊ��������KOH��Һ��Ϊ�������Һ�����ڸõ�ص�������ȷ���ǣ�������

A. b������������Ӧ
B. a��Ϊ�õ�ص�����
C. �ŵ�ʱ��������a��������������b��
D. a���ķ�Ӧʽ��N2H4+4OH����4e���TN2��+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������![]() �������ڵ��ƾ��в�ݮ�����ѡ�ӣ�ҡ�����������ζ��ʳ���㾫��
�������ڵ��ƾ��в�ݮ�����ѡ�ӣ�ҡ�����������ζ��ʳ���㾫��
��1�����������к��������ŵ�������_________
��2�������й����������������У���ȷ����_________������ĸ����
A��������������Ȼ�̼��Һ�����ӳɷ�Ӧ
B������ʹ���Ը��������Һ��ɫ
C���ڼ����������ܷ���ˮ�ⷴӦ
D�����Է����Ӿ۷�Ӧ
��3��GΪ����������һ��ͬ���칹�壬����ӽṹģ������ͼ��ʾ��ͼ��������֮�����߱�ʾ������˫��������G�Ľṹ��ʽΪ_________

��4���÷�����AΪԭ�Ϻϳ�G��·�����£�
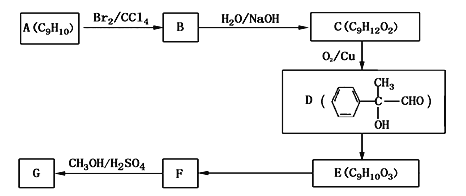
��A�Ľṹ��ʽ________
��E��F�ķ�Ӧ������_______
��C��D�Ļ�ѧ����ʽΪ__________________
��д����������������F��ͬ���칹��Ľṹ��ʽ__________
���������ں��������ұ�����ֻ��һ��֧����
����һ�������£�1mol������������������Һ��ַ�Ӧ������4mol�����ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ���Ʊ�ϩ���ij��÷�����ʵ�����Ʊ�����ϩ�ķ�Ӧ��ʵ��װ����ͼ��ʾ�������õ����й��������£�

��Է������� | �ܶ�/��gcm��3�� | �е�/�� | �ܽ��� | |
���Ҵ� | 100 | 0.9618 | 161 | ����ˮ |
����ϩ | 82 | 0.8102 | 83 | ������ˮ |
a�м���20g��������2СƬ���Ƭ����ȴ��������������1mLŨ���ᣮb��ͨ����ȴˮ��ʼ��������a�������������¶Ȳ�����90�森��Ӧ�ֲ��ﵹ��f�����зֱ�������5%̼������Һ��ˮϴ�ӣ�����������ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ƣ�����ͨ������õ���������ϩ���ش��������⣺
��1���ɻ�������ȡ����ϩ�ķ���ʽ_________________��
��2��װ��b������ˮ������________________�������½��ϳ��������Ͻ��³�������
��3���������һ��ʱ��������ǼӴ�Ƭ��Ӧ�ò�ȡ����ȷ������___��ѡ�𰸣���
A���������� B����ȴ�� C�����貹�� D����������
��4����ʵ���������ײ����ĸ����������Ĺ��������Ƽ���Ӧ����Ϊ_____��____��
��5���ڷ����ᴿ�У�ʹ�õ�������f������___________��
��6���ϳɹ����м���Ũ�����������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ����ˮ��ɹ�ɵô��Σ����γ�NaCl�⣬������MgCl2��CaCl2��Na2SO4�Լ���ɳ�����ʡ��������Ʊ����ε�ʵ�鷽������������������ͼ��

��1���ڵڢٲ������ܽ������Ҫ�ò��������裬������______��
��2���ڢڲ�������Ŀ���dz�ȥ�����е�______���ѧʽ����ͬ�����ڢ�������Ŀ���dz�ȥ��Һ��______��
��3���ڢݲ������ˡ������еõ������ijɷ��У���ɳ��BaSO4��Mg��OH��2��______���ѧʽ����
��4���ڵڢ۲������У�ѡ��ij��ӵ��Լ�������KOH����NaOH��������______��
��5��ʵ�����þ��ε��������ڴ�����NaCl��������ԭ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������1 mol HNO3��1 mol NaHSO4�Ļ����Һ��������������������Һ�н���������a��b���������۵����ʵ����Ĺ�ϵ��ͼ��ʾ(��֪ϡ����Ļ�ԭ����ֻ��NO)�������й��ж�����ȷ���ǣ� ��
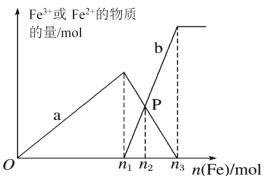
A.a��ʾFe3���Ĺ�ϵ���ߣ�b��ʾFe2+�Ĺ�ϵ����
B.n1��0.5
C.P��ʱ��n(Fe2��)��0.3mol
D.��P����Һ�м���ͭ�ۣ������ܽ�14.4g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ᾭ�õķ�չ�������ѽ���ǧ�����������dz��д��������ͬʱ����β����Ⱦ����Ҳ����ͻ�ԣ�����β���к�![]() �������������ȡ��û���̿��ԭ��������������һ��ʵ�õĵ�������ת��������
�������������ȡ��û���̿��ԭ��������������һ��ʵ�õĵ�������ת��������![]() ����ʵ�ֵ���������ת�������ڸ÷�Ӧ����˵������ȷ����( )
����ʵ�ֵ���������ת�������ڸ÷�Ӧ����˵������ȷ����( )
A.�����¶��ܹ��ӿ췴Ӧ����
B.����NOŨ���ܹ�������Ӧ����
C.ʹ�ú��ʵĴ������Լӿ췴Ӧ����
D.����������̿�ۿ���ʹ![]() ת��
ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������·�Ӧ2AB(g)![]() A2(g)��B2(g)�ﵽƽ��״̬�ı�־��
A2(g)��B2(g)�ﵽƽ��״̬�ı�־��
A. ��λʱ��������nmolA2��ͬʱ����2n molAB
B. �����ڣ�3������AB��A2��B2����
C. AB���������ʵ���A2����������
D. �����и���ֵ������������ʱ��仯
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com