
【化学—选修2:化学与技术】(15分)
生态工业园区的建设,不仅仅是体现环保理念更要依据循环经济理论和充分考虑经济的可持续发展。下面是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产三大生态产业链流程图。
根据上述产业流程回答下列问题:
(1)从原料、能源、交通角度考虑该企业应建在( )
| A.西部山区 | B.沿海地区 | C.发达城市 | D.东北内陆 |
(15分)(1)B(2分)
(2)① Fe2O3 ② 电能 ③热能 ④SO2 ⑤浓H2SO4(共5分,每空1分)
(3) 4FeS2 + 11O2高温 2Fe2O3 + 8SO2(2分,无高温条件给1分)
Ca(H2PO4)2·H2O或Ca(H2PO4)2、CaSO4(2分)
(4)海水 镁或溴 (共2分,各1分)
(5)废气(主要是高炉煤气),经除尘后可作为热风炉、加热炉和锅炉等的燃料。
废渣(主要成分是硅酸钙等),可用作水泥生产原料;也可用作矿渣磷肥的生产原料。
余热 ,为延长高炉的使用寿命,用水在外部冷却,废热主要转化为热水用于发电或取暖。(回答出两点即可)(共2分,每一点1分)
解析试题分析:(1)A、西部山区交通不方便,不可取;B、建在沿海地区,运输硫铁矿比较便利,且废热利用,远离市区,用水比较方便,正确;C、建在城市会污染较严重,影响居民生活,错误;D、东北内陆远离海水,运输海水比较困难,错误,所以综合考虑选择B;
(2)①硫铁矿燃烧后得Fe2O3,用于炼铁;②废热发电输送电能;③硫铁矿燃烧产生的废热,用于发电,所以输送的是热能;④吸收塔中未反应的SO2重新回到接触室继续被氧化为三氧化硫;⑤吸收塔是用硫酸吸收三氧化硫产生的浓硫酸用于制造化肥;
(3)沸腾炉内是硫铁矿的燃烧反应,化学方程式为4FeS2 + 11O2高温 2Fe2O3 + 8SO2;硫酸与磷酸钙反应制取普钙,主要成分是Ca(H2PO4)2·H2O或Ca(H2PO4)2、CaSO4;
(4)热电厂用的冷却水是海水,因为沿海地区有丰富的海水资源;海水中富含镁、溴等,所以还可以提取镁、溴;
(5)根据工厂的废气、废渣的成分可知,废气(主要是高炉煤气)经除尘后可作为热风炉、加热炉和锅炉等燃料;废渣(主要成分是硅酸钙等),可用作水泥生产原料;余热 ,为延长高炉的使用寿命,用水在外部冷却,废热主要转化为热水用于发电或取暖。
考点:考查工艺流程、工业原理,对工业原理的分析


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:单选题
下列有关说法正确的是
| A.高温加热氧化镁和碳的混合物可以制单质镁 |
| B.铁的冶炼过程是通过置换反应得到单质铁 |
| C.海水提溴的过程中不发生氧化还原反应 |
| D.利用电解的方法可以从海水中获得淡水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海水中镁的总储量约为2.1×1015t,目前世界上60%的镁来自海水,工业规模海水提镁的流程如图所示:
试回答下列问题:
(1)海水提镁的过程中①、②反应的化学方程式:
①_____________________________________,
②______________________________________。
(2)由氯化镁溶液制取无水氯化镁固体,其操作过程是____________________
(3)为了使MgSO4完全转化为Mg(OH)2,则加入的生石灰要过量,然后分离得Mg(OH)2沉淀,考虑Ca(OH)2溶解度,应该用________法分离。
(4)金属镁、铝的工业冶炼方法既有相似之处,又有不同之别,下表是氧化镁和氯化镁的熔沸点数据:
| 物质 | 氧化镁 | 氯化镁 |
| 熔点(℃) | 2 852 | 714 |
| 沸点(℃) | 3 600 | 1 412 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ下列说法不正确的是____ 。
| A.可以利用某些炼钢废渣来生产磷肥 |
| B.具有永久硬度的水主要用加热的方法来进行软化 |
| C.硫酸工业中,在接触室安装热交换器是为了利用S03转化为H2S04时放出的热量 |
| D.合成氨工业原料气净化时,常用碳酸钾溶液吸收除去二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
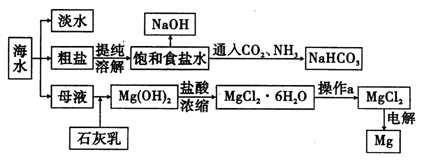
下图是某工厂对海水资源进行综合利用的示意图。
请回答下列问题:
(1)请列举一种海水淡化的方法 。
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是 ,NaOH在电解槽的 室生成,由饱和食盐水制取NaOH的化学方程式为 。
(3)侯氏制碱法中向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入 (填化学式),理由是 。再由NaHCO3制得纯碱,化学方程式为 。
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取。已知有关物质的熔沸点数据如下:
| | MgO | MgCl2 |
| 熔点/℃ | 2 852 | 714 |
| 沸点/℃ | 3 600 | 1 412 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钢铁工业对促进经济和社会发展起了重要作用。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在________部分发生反应,在________部分开始生成生铁和炉渣。
(2)炼钢时,除磷的化学方程式为____________________;加入硅、锰和铝的目的是________________________。
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹________(填“前”或“后”)加入,原因是______________________。
(4)炼铁和炼钢生产中,尾气中均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧—钠氧化法”回收Na2Cr2O7等物质。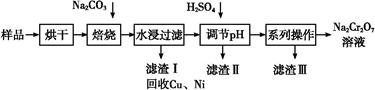
已知:在Na2CrO4溶液中含有少量NaAlO2、Na2ZnO2等物质
(1)水浸后的溶液呈 性(填“酸”、“碱”或“中”)。
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式。
Cr(OH)3+ Na2CO3+  Na2CrO4+ CO2+
Na2CrO4+ CO2+
(3)滤渣Ⅱ的主要成分有Zn(OH)2、 。
(4)“系列操作”中为:继续加入H2SO4, ,冷却结晶,过滤。继续加入H2SO4目的是 。
已知:①除去滤渣II后,溶液中存在如下反应:
2CrO42—+2H+ Cr2O72—+H2O
Cr2O72—+H2O
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
| 温度 溶解度 化学式 | 20 ℃ | 60 ℃ | 100 ℃ |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。工业上常采用NaClO氧化法生产,其生产工艺如下:
主要反应为:3NaClO+2Fe(NO3)3+10NaOH = 2Na2FeO4↓+3NaCl+6NaNO3+5H2O
Na2FeO4+2KOH=K2FeO4+2NaOH。
(1)写出反应①的离子方程式: 。
(2)从“混合物II”中分离出K2FeO4后,会有副产品,它们都是重要的化工产品,其中一种在工业上用作氯碱工业原料的物质是 。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。图Ⅰ为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;图Ⅱ为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。
图Ⅰ 图Ⅱ
根据上图分析:工业生产中最佳温度为 ℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com