
| A. | “可燃冰”释放的甲烷属于烃 | |
| B. | “可燃冰”的分解与释放,可能会诱发海底地质灾害,加重温室效应 | |
| C. | “可燃冰”将成为人类的后续能源 | |
| D. | “可燃冰”是水变的油 |
科目:高中化学 来源: 题型:选择题
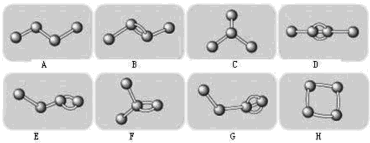
| A. | 互为同系物的有机物其组成元素相同,且结构必须相似 | |
| B. | 正戊烷分子中所有碳原子均在一条直线上 | |
| C. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| D. | 互为同系物的有机物其相对分子质量数值一定相差14 n(n为正整数) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO3- | B. | MnO4- | C. | Cl2 | D. | Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向溶解有Na2O2的水溶液中滴入2滴酚酞试液,溶液先变红振荡后褪色 | |
| B. | 氯气的性质活泼,它与氢气混合后立即发生爆炸 | |
| C. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到黑色Fe3O4 | |
| D. | 新制的氯水加入有色布条褪色,说明溶液中有Cl2存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编 号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
| 0.1mol•L-1KI溶液 | 0.1mol•L-1H2O | X 0.1mol•L-1溶液 | 0.1mol•L-1双氧水 | 0.1mol•L-1稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
| 5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. .
. .
. .
. (写结构简式):
(写结构简式):查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑦ | |||
| 4 | ⑥ | ⑧ |
 .写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com