
【题目】在2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O反应中,下列说法正确的是
A. 氧化产物与还原产物物质的量之比5∶2
B. 2mol KMnO4完全反应,转移的电子数为16NA
C. 该反应中HCl做还原剂,KCl、MnCl2是氧化产物
D. 氧化剂与还原剂的物质的量之比5∶1
科目:高中化学 来源: 题型:
【题目】下列有关仪器的使用方法或实验操作正确的是( )
A.盛装碱性试剂的试剂瓶应该使用橡皮塞
B.分离酒精和水可以采用分液法
C.蒸发结晶时应该将水分全部蒸干
D.在托盘天水左右托盘各放质量大小相同的纸,在左边纸上放氢氧化钠称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸晶体(H2C2O4·XH2O)可溶于水,并可与酸性高锰酸钾溶液完全反应:2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+10CO2↑+8H2O。现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,三次结果如下:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在________(填酸式或碱式)滴定管中。
(2)在整个实验过程中,不需要的仪器或用品是______(填序号)。
①100mL容量瓶②烧杯③滴定管夹④漏斗⑤玻璃棒⑥托盘天平
(3)到达滴定终点的标志是____________________________________________。
(4)根据上述数据计算X=________________。
(5)误差分析(填偏高、偏低或无影响):
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值________;
②若KMnO4标准溶液浓度偏低,则X值_________;
③若锥形瓶洗净后瓶内还残留有少量蒸馏水,则X值____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)下列物质不属于硅酸盐的是____。
A.陶瓷 B.玻璃 C.水泥 D.生石灰
(2)玉石的主要成分基本都属于硅酸盐,翡翠的主要成分为NaAlSi2O6,将其表示为氧化物形式为_________________________。
(3)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作______。Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是___。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.瓷坩埚 D.铁坩埚
(4)高纯度单晶硅可以按下列方法制备:
SiO2 ![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3 ![]() Si(纯)
Si(纯)
写出步骤①的化学方程式___________________________________________________。步骤②的产物经过冷凝后得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃),提纯SiHCl3主要操作的名称是_________。步骤③需要在无水无氧环境下进行,若在有氧环境下,除了有不安全因素外还可能使产品中混有杂质____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应基本原理不仅具有理论意义,而且具有实用价值。
(1)为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
已知:①N2(g)+O2(g)=2NO(g) △H1=+ 180.5kJ/mol
②2C(s)+O2(g)=2CO(g) △H2=-221.0kJ/mol
③C(s) +O2(g)=CO2(g) △H3=-393.5kJ/mol
则△H=______kJ/mol
(2)工业上常用反应CO(g) +2H2(g)![]() CH3OH(g) △H=-90.7kJ/mol 合成甲醇,恒温恒容条件下,能说明该反应一定达到平衡状态的是_____(填字母)。
CH3OH(g) △H=-90.7kJ/mol 合成甲醇,恒温恒容条件下,能说明该反应一定达到平衡状态的是_____(填字母)。
a.混合气体的密度不再随时间改变
b.气体的总压强不再随时间改变
c.CO和CH3OH 的浓度之比不再随时间改变
d.v消耗(CO)=v生成(CH3OH)
(3)草木灰是农家肥料,它的主要成分是碳酸钾,其水溶液显____(填“ 酸性”、“ 碱性”或“ 中性”),原因是___________(用离子方程式表示)。
(4)向含有相同浓度Fe2+、Hg+的溶液中滴加Na2S溶液,先生成______沉淀(填化学式)。在工业废水处理过程中,依据沉淀转化原理,可用FeS作为沉淀剂除去废水中的Hg2+,写出相应的离子方程式___________________。(Ksp(FeS)=6.3×10-18,Ksp(HgS)=6.4×10-53)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
(3)C、H、O 三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
(5)某FexNy的晶胞如题21图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如题21图-2 所示,其中更稳定的Cu替代型产物的化学式为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据下列能量变化示意图,请写出![]() 和CO反应的热化学方程式______。
和CO反应的热化学方程式______。

(2)在固定体积的密闭容器中,进行如下化学反应: ![]()
![]() H<0,其平衡常数K与温度T的关系如下表:
H<0,其平衡常数K与温度T的关系如下表:
T/K | 298 | 398 | 498 |
平衡常数K |
|
|
|
①试判断![]() ______
______![]() (填写>、=,<)
(填写>、=,<)
②下列各项能说明该反应已达到平衡状态的是_______(填字母)
a. 容器内![]() 、
、![]() 、
、![]() 的浓度之比为1:3:2
的浓度之比为1:3:2
b. ![]()
c. 容器内压强保持不变
d. 混合气体的密度保持不变
(3)对反应![]()
![]() H>0,在温度分别为
H>0,在温度分别为![]() 、
、![]() 时,平衡体系中
时,平衡体系中![]() 的体积分数随压强变化曲线如下图所示。
的体积分数随压强变化曲线如下图所示。

①A、C两点的反应速率:A_________C(填>、=、<)
②A、C两点![]() 的转化率:A_________C(填>、=、<)
的转化率:A_________C(填>、=、<)
③由状态B到状态A,可以采用的方法是__________。
(4)一定温度下
①若在1L的密闭容器中,充入1 mol![]() 和3 mol
和3 mol![]() 发生反应,并维持容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则
发生反应,并维持容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则![]() 的转化率a(
的转化率a(![]() )=______,以
)=______,以![]() 表示该过程的反应速率v(
表示该过程的反应速率v(![]() )=_________.
)=_________.
②若在1L的密闭容器中,充入2mol![]() 和6mol
和6mol![]() 发生反应,并维持压强恒定,达到平衡时,
发生反应,并维持压强恒定,达到平衡时, ![]() 平衡浓度比①中
平衡浓度比①中![]() 平衡浓度的2倍________。(填>、=、<)
平衡浓度的2倍________。(填>、=、<)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸工业废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等。回收废渣中金属元素的工艺流程如下:
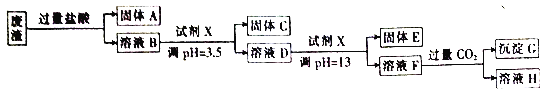
已知常温条件下:
①阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol/L)时的pH如下表所示。
阳离子 | Fe3+ | A13+ | Mg2+ |
开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
恰好完全沉淀时的pH | 3.2 | 5.2 | 11.0 |
②饱和氨水溶液中c(OH-)约为1×10-3mol/L。
请回答下列问题:
(1)固体C为________(填化学式)。
(2)上述流程中两次使用试剂X,试剂X是________(填“氨水”或“氢氧化钠”),其理由是________ 。
(3)向溶液D中滴人试剂X的过程中,发生反应的离子方程式有Mg2++2OH-=Mg(OH)2、________、________。
(4)溶液D→固体E的过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________。
(5)写出溶液F→溶液H的离子方程式: ________ 。
(6)Ksp[Mg(OH)2]= ________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com