
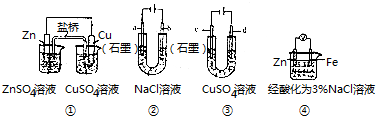
| A. | 装置①中,盐桥(含有琼胶的KCl饱和溶液)中的K+移向ZnSO4溶液 | |
| B. | 装置②工作一段时间后,a极附近溶液的pH减小 | |
| C. | 用装置③精炼铜时,c极为纯铜 | |
| D. | 装置④中电子由Zn流向Fe,装置中有Fe2+生成 |
分析 A、原电池中阳离子向正极移动,铜是正极;
B、装置②工作一段时间后,a极与电源的负极相连是阴极,电极反应式为:水中的氢离子放电,产生氢氧根离子;
C、精炼铜时,纯铜为阴极;
D、活泼金属锌是负极,所以产生锌离子.
解答 解:A、原电池中阳离子向正极移动,铜是正极,所以K+移向CuSO4溶液,故A错误;
B、装置②工作一段时间后,a极与电源的负极相连是阴极,电极反应式为:水中的氢离子放电,产生氢氧根离子,所以溶液的PH值增大,故B错误;
C、精炼铜时,纯铜为阴极,所以c为阴极,c极为纯铜,故C正确;
D、活泼金属锌是负极,所以产生锌离子,而不是亚铁离子,故D错误;
故选C.
点评 本题考查电化学的相关知识,涉及离子的移动方向、电极的反应后PH的变化和电镀等,综合性强,但比较容易.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
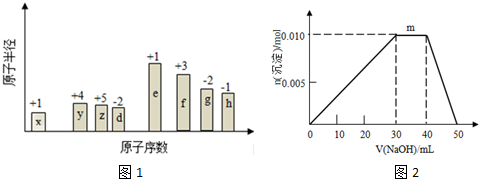
 ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验室制取乙烯 | B. | 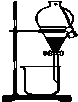 利用酒精萃取碘水中的I2单质 | ||
| C. | 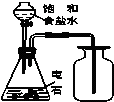 实验室制取乙炔并收集 | D. | 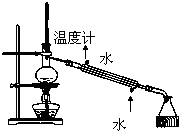 石油的分馏实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.05mol/(L•min) | B. | 3v(B)=2v(C) | ||
| C. | v(B)=0.15mol/(L•min) | D. | A的转化率为40% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.10mol•L-1Ag+ | B. | 0.20mol•L-1Zn2+ | C. | 0.20mol•L-1Cu2+ | D. | 0.20mol•L-1Pb2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com