
���и���Һ�У��������ʵ���Ũ�ȹ�ϵ��ȷ����
| A��0.1 mol��L��1 Na2CO3��Һ��c(Na+)=2c(HCO3��)+2c(CO32��)+2c(H2CO3) |
| B��0.1 mol��L��1 NH4Cl��Һ��c(NH4+)=c(Cl��) |
| C�����������Һ�м����������ᣬ�õ������Ի����Һ��c(Na+) > c(CH3COO��) > c(H+) > c(OH��) |
| D�������£���pH=2�������pH=12�İ�ˮ�������Ϻ�c(NH4+) > c(Cl��) > c(OH��) > c(H+) |
AD
�������������A��Na2CO3��Һ�У����ݻ�ѧʽ�ɵ������غ��ʽc(Na+)=2c(HCO3��)+2c(CO32��)+2c(H2CO3)����ȷ��B��NH4Cl��Һ��笠�����ˮ��ʹc(NH4+)<c(Cl��)������C����������Һ�м����������ᣬ�õ������Ի����Һ��˵���������̶ȴ��ڴ��������ˮ��̶ȣ�����c(CH3COO��) > c(Na+)������D����ˮ��������Һ������ˮ��Ũ�ȴ��������Ũ�ȣ��������Ϻ�ˮ��������Һ�ʼ��ԣ�����c(NH4+) > c(Cl��) > c(OH��) > c(H+)����ȷ����ѡAD��
���㣺��������Һ��ˮ�⣬����Ũ�ȵıȽϣ��غ���ɵ�Ӧ��


 ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
25 ���ڵ�����Ģ�pH=0��H2SO4��Һ����0��05 mol��L��1��Ba(OH)2��Һ����pH = 10��Na2S��Һ����pH=5��NH4NO3��Һ�У����������ˮ�����ʵ���֮����(�������� )
| A��1��10��1010��109 | B��1��5��5��109��5��109 |
| C��1��20��1010��109 | D��1��10 ��104��109 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵���������ȷ����
| A��CH3COONa��Һ�м�������KNO3�����ļ�����Һһ���У� C(Na+)��c(CH3COO��)=c(OH��)��c(H+) |
| B����ZnS��ɫ����Һ�м���CuSO4��Һ���к�ɫ��������������ΪKsp (ZnS)��Ksp (CuS) |
| C������ڵ�NaOH��Һ�еμ�FeCl3������Һ�������Ʊ�Fe(OH)3���� |
| D����ˮ�м���NaCl�ܽ������ͺ���Һ��pH����7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£�0.2mol/LһԪ��HA���Ũ�ȵ�NaOH��Һ�������Ϻ�������Һ�в�������ּ�Ũ����ͼ��ʾ������˵����ȷ����
| A��HA��ǿ�� |
| B���û��ҺpH=7 |
| C��ͼ��x��ʾHA��Y��ʾOH-��Z��ʾH+ |
| D���û����Һ�У�c(A-)+c(Y)=c��Na+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£�Ũ�Ⱦ�Ϊ0.1mol/L����Һ���ٰ�ˮ�������ᡢ���Ȼ����Һ������˵������ȷ����
| A��c(NH4+)���ۣ��� |
| B��ˮ�������c(H+)���ڣ��� |
| C���ٺ͢ڵ������Ϻ����Һ��c(NH4+)+c(NH3��H2O)��0.05mol/L |
| D���ٺ͢۵������Ϻ����ҺpH��7��c(NH4+)��c(Cl��)��c(OH��)��c(H+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����ʵ���ܴﵽԤ��Ŀ�ĵ��� �� ��
| ��� | ʵ������ | ʵ��Ŀ�� |
| A | �����£���pH��ֽ�ֱ�ⶨŨ��Ϊ0.1mol��L��1NaClO��Һ��0.1mol��L��1CH3COONa��Һ��pH | �Ƚ�HClO��CH3COOH������ǿ�� |
| B | ���з�̪��Na2CO3��Һ�м�������BaC12���壬��Һ��ɫ��dz | ֤��Na2CO3��Һ�д���ˮ��ƽ�� |
| C | ��10mL 0.2 mol/L NaOH��Һ�е���2��0.1 mol/L MgCl2��Һ��������ɫ�������ٵμ�2��0.1 mol/LFeCl3��Һ�������ɺ��ɫ���� | ֤������ͬ�¶��µ�Ksp�� Mg(OH)2 ��Fe(OH)3 |
| D | �ֱ�ⶨ�����µ����ʵ���Ũ�ȵ�Na2SO3��Na2CO3��Һ��pH�����߽ϴ� | ֤���ǽ�����S��C |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
25��ʱ��0.1mol Na2CO3�����������õ�һ�����Ϊ1 L����Һ����Һ�в�������pH�Ĺ�ϵ��ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ������ȷ���� 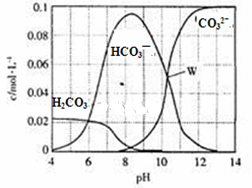
| A��W����ʾ����Һ�У�c (Na+)+c (H+)��2c(CO32- )+c (OH-)+c (Cl-) |
| B��pH= 4����Һ�У�c (H2CO3)+c (HCO3-)+c (CO32-)��0.1mol��L-1 |
| C��pH=8����Һ�У�c (H+)+c (H2CO3)+c (HCO3-)�� c (OH-)+c (Cl- ) |
| D��pH=11����Һ�У�c (Na+)��c (Cl-)��c (CO32- )��c (HCO3- )��c (H2CO3) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�ڲ�ͬ�¶��£�ˮ��Һ��c(H��)��c(OH��)����ͼ��ʾ��ϵ������˵����ȷ���ǣ� ��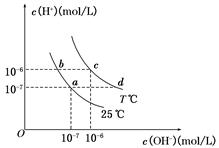
A��a���Ӧ����Һ��c���Ӧ����ҺpHֵ��С��
pH��c����pH��a��
B��d���Ӧ����Һ�д������ڣ�K+��Ba2����NO3����I��
C��25��ʱ��Ka(HF)��3.6��10��4,Ka��CH3COOH����1.75��10��5,
0.1mol/L��NaF��Һ��0.1mol/L ��CH3COOK��Һ��ȣ�
c(Na��)��c(F��)��c(K��)��c(CH3COO��)
D����b���Ӧ����Һ��ֻ��NaHA������Һ������Ũ�ȴ�С��
c(HA��)��c(H2A)��c(H��)��c(A2��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£���20.00 mL 0.1000 mol��L��1CH3COONa��Һ����μ���0.1000 mol��L��1���ᣬ�����Һ��pH��������������Ĺ�ϵ��ͼ��ʾ������˵����ȷ����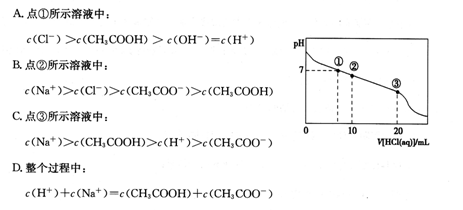
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com