
| A. | 标准状况下,11.2 L CCl4含有的分子数目为0.5NA | |
| B. | 1 mol Na2O2固体中含离子总数为3NA | |
| C. | 将10mL 1mol•L-1FeCl3溶液滴入沸水中,所得氢氧化铁胶粒数为0.01NA | |
| D. | 0.1 molH2O和D2O组成的混合物中含有中子数是NA |
分析 A、标况下,四氯化碳为液体;
B、过氧化钠由2个钠离子和1个过氧根构成;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
D、H2O中含8个中子,而D2O中含10个中子.
解答 解:A、标况下,四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含2mol钠离子和1mol过氧根共3mol离子即3NA个,故B正确;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故所得的氢氧化铁胶粒小于0.01NA个,故C错误;
D、H2O中含8个中子,而D2O中含10个中子,故0.1mol水和重水的混合物中含有的中子个数介于0.8NA到NA之间,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Y、Z形成的化合物为离子化合物 | |
| B. | Y2-的离子半径大于W3+的离子半径 | |
| C. | W的最高价氧化物对应的水化物的酸性比X的强 | |
| D. | Z的气态简单氢化物的稳定性比R的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小C和D的浓度 | B. | 增大D的浓度 | C. | 减小B的浓度 | D. | 增大A和B的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g C和32g O2所具有的总能量大于44g CO2所具有的总能量 | |
| B. | 12g C所具有的能量一定高于28g CO所具有的能量 | |
| C. | 56g CO和32g O2所具有的总能量大于88gCO2所具有的总能量 | |
| D. | 将一定质量的C燃烧,生成CO2比生成CO时放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
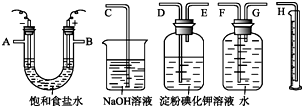 请用如图所示仪器设计一个电解饱和食盐水并测定电解时产生的H2的体积和检验Cl2的实验装置.(提示:Cl2可与KI反应生成I2,淀粉遇I2变蓝)
请用如图所示仪器设计一个电解饱和食盐水并测定电解时产生的H2的体积和检验Cl2的实验装置.(提示:Cl2可与KI反应生成I2,淀粉遇I2变蓝)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量:④<①<③<② | B. | 密度:①<④<③<② | ||
| C. | 体积:④<①<②<③ | D. | 氢原子数:②<④<③<① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
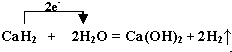 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com