
| 元素 | A | B | C | D |
| 性质 结构 信息 | 单质银白色,燃烧时火焰呈黄色. | 其单质是空气的主要成分,化学性质非常稳定. | 原子的3p亚层上有5个电子. | +2价阳离子的核外电子排布与氖原子相同. |
分析 A的单质银白色,燃烧时火焰呈黄色,则A为Na元素;B的单质是空气的主要成分,化学性质非常稳定,则B为N元素;C原子的3p亚层上有5个电子,则C原子含有3个电子层,最外层含有7个电子,为Cl元素;D的+2价阳离子的核外电子排布与氖原子相同,则D为Mg元素,据此结合元素周期律知识解答.
解答 解:(1)A的单质银白色,燃烧时火焰呈黄色,则A为Na元素;B的单质是空气的主要成分,化学性质非常稳定,则B为N元素;C原子的3p亚层上有5个电子,则C原子含有3个电子层,最外层含有7个电子,为Cl元素;D的+2价阳离子的核外电子排布与氖原子相同,则D为Mg元素,
根据分析可知,元素A、B、C、D分别为Na、N、Cl、Mg,
故答案为:Na;N;Cl;Mg;
(2)A原子为Na原子,钠原子核外电子有1s、2s、2p、3s,总共有4种;
D离子为镁离子,镁离子的核外电子总数为10,其核外电子排布式为:1s22s22p6,
故答案为:4;1s22s22p6;
(3)D、C形成的化合物为氯化镁,氯化镁为离子化合物,属于离子晶体;四氯化碳形成的晶体为分子晶体,氯化镁形成的晶体为离子晶体,所以氯化镁晶体的沸点大于四氯化碳晶体,
故答案为:离子;R是离子晶体,固态四氟化碳是分子晶体;
(4)由于金属钠能从熔融的氯化镁中置换出金属镁,说明Na的金属性大于Mg,
故答案为:金属钠能从熔融的氯化镁中置换出金属镁;
(5)测定氯化铵溶液的pH<7,说明氯化铵溶液中铵根离子部分水解,从而可证明一水合氨为弱碱,
故答案为:测定氯化铵溶液的pH值,测得其pH<7.
点评 本题考查了原子晶体与元素周期律的关系,题目难度中等,涉及电子排布式、金属性强弱判断、强弱电解质的判断、晶体类型及性质应用等知识,推断元素为解答关键,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | Si-Si | Si-H |
| 键能/(kJ•mol-1) | 356 | 413 | 226 | 318 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42- | B. | HCO3- | C. | SO32- | D. | Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{18}$O | |
| B. | 氧离子(O2-)的结构示意图: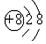 | |
| C. | 氧原子最外层p亚层电子排布式:2s22p4 | |
| D. | 某碳氧化合物电子式: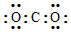 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| B. | 中和滴定实验中,锥形瓶用蒸馏水洗净须经烤箱烘干后才可使用 | |
| C. | 配制0.5mol•L-1、480mL的NaOH溶液需称量9.6g的NaOH固体作溶质 | |
| D. | 某溶液中滴入2滴K3[Fe(CN)6]溶液生成具有特征蓝色的沉淀,说明原溶液中含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L 标准盐酸溶液滴定未知浓度氨水,可以使用甲基橙作指示剂 | |
| B. | 向0.01mol/L酸性高锰酸钾溶液中滴加适量0.1mol/L草酸溶液,振荡,一段时间后溶液突然变为无色 | |
| C. | 向1mol/L KI溶液中逐滴滴加适量0.1mol/L稀硫酸和淀粉溶液,振荡,一段时间后无明显现象 | |
| D. | 向1mL 0.1mol/L MgCl2溶液的试管中滴加1~2滴2mol/L NaOH溶液,振荡后出现白色沉淀,再滴加2滴0.1mol/L FeCl3溶液,沉淀变为红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ne和Na+的结构示意图均为 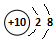 | B. | 聚氯乙烯的结构简式为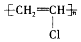 | ||
| C. | 二氧化碳分子的比例模型: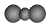 | D. | NH4Br的电子式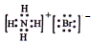 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
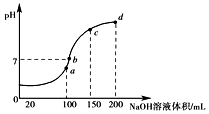 NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下
NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com