
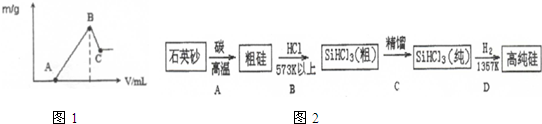
| 1 |
| 2 |
| 1 |
| 2 |
 ;稀有气体不活泼,和一般的金属不反应,所以焊接镁铝合金时使用的保护气是稀有气体,故答案为:
;稀有气体不活泼,和一般的金属不反应,所以焊接镁铝合金时使用的保护气是稀有气体,故答案为: ;稀有气体;
;稀有气体;| 1 |
| 2 |
| 1 |
| 2 |
|
|
| ||
| ||


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源:四川省蓬安中学2007级高三第一次月考化学试题 题型:022
| |||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知:在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。请写出表示甲醇燃烧的热化学方程式。
(2)测定工业甲醇中CH3OH的质量分数可按下法:取0.100 0 g工业甲醇样品,以适量H2SO4酸化后,加入20.00 mL 0.200 0 mol·L-1的K2Cr2O7溶液,过量的K2Cr2O7溶液,再用0.300 0 mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定,耗去此标准液20.00 mL时,刚好到达滴定终点。
已知:CH3OH+![]() +8H+
+8H+![]() CO2↑+2Cr3++6H2O
CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式。
②求此工业甲醇中CH3OH的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
能源是人类社会发展进步的物质基础。在当代,能源同信息、材料一起构成了现代文明的三大支柱。
(1)为了降低汽车尾气对大气的污染,江苏有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知:在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。请写出表示甲醇燃烧热的热化学方程式。
(2)测定工业甲醇中CH3OH的质量分数可按下法:取0.1000g工业甲醇样品,以适量H2SO4酸化后,加入20.00mL 0.2000mol/L的K2Cr2O7溶液,再用0.3000mol/L (NH4)2Fe(SO4)2标准溶液滴定,耗去此标准液20.00mL时,刚好到达滴定终点。
已知:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式。
②此工业甲醇中CH3OH的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
能源是人类社会发展进步的物质基础,在当代,能源、信息、材料一起构成了现代文明的三大支柱。为了缓解能源危机和减少汽油燃烧所产生的污染,目前已普遍推广使用新型车用燃烧――乙醇汽油。乙醇汽油是将乙醇和普通汽油按一定体积比混合而成的,已知某乙醇汽油蒸气中乙醇和汽油的体积比约为1:4。请回答下列问题:
(1)若以辛烷代表汽油的成分,请写出乙醇汽油燃烧的化学方程式:
。
(2)若以辛烷代表汽油的成分,并设空气中氧气所占的体积分数为![]() ,则相同条件下,相同体积汽油、乙醇汽油分别在气缸内完全燃烧时,所消耗空气的体积比是 。
,则相同条件下,相同体积汽油、乙醇汽油分别在气缸内完全燃烧时,所消耗空气的体积比是 。
(3)若用乙醇汽油设计燃料电池,在一个电极通入空气,另一个电极通入乙醇汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,则该电极正极发生的电极反应是 。
(4)据最新报道,巴西新一代乙醇燃料汽车总量已突破200万辆,为了更好推广乙醇燃料汽车的使用,巴西政府决定向普通汽车购买者征收16%的消费税,而只向乙醇燃料汽车购买者征收14%的消费税。巴西地处南美洲,是世界上甘蔗产量巨大的国家之一,乙醇是从甘蔗中提炼中加工出来的。请写出由甘蔗渣制备乙醇的化学反应方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com