
下列关于杂化轨道的叙述中,不正确的是()
A. 分子中中心原子通过sp2杂化轨道成键时,该分子不一定为平面三角形结构
B. 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子
C. N2分子中N原子没有杂化,分子中有1个σ键、2个π键
D. H2SO4分子中三种原子均以杂化轨道成键
考点: 原子轨道杂化方式及杂化类型判断.
分析: A.分子中中心原子通过sp2杂化轨道成键时,如果存在孤电子对,则该分子空间构型不是平面三角形;
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子,不能形成π键;
C.氮气分子中N原子之间存在3对共用电子对,一个头对头、两个肩并肩形成化学键;
D.硫酸分子中S原子为sp3杂化.
解答: 解:A.分子中中心原子通过sp2杂化轨道成键时,如果存在孤电子对,则该分子空间构型不是平面三角形,如果没有孤电子对,则分子空间构型为平面三角形,故A正确;
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子,不能形成π键,π键是肩并肩形成的,故B正确;
C.氮气分子中N原子之间存在3对共用电子对,一个头对头、两个肩并肩形成化学键,所以分子中有1个σ键、2个π键,故C正确;
D.H2SO4硫酸分子中S原子为sp3杂化,O﹣H为共用电子对形成的化学键,不是以杂化轨道成键,故D错误;
故选D.
点评: 本题考查杂化轨道和杂化理解,侧重考查对基本概念、基本理论的理解,知道原子杂化方式的判断方法,为2015届高考热点,题目难度中等.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列与这些用途无关的性质是( )。
A.不易生锈 B.导电性好
C.密度小 D.强度高
查看答案和解析>>
科目:高中化学 来源: 题型:
TESLA电动汽车的电池采用了松下提供的NCA系列(镍钴铝体系)的18650A型钴酸锂(LiCoO2)锂离子电池。电池正极材料为钴酸锂(LiCoO2),负极材料是石墨(C6)。电池反应为: LiCoO2+C6 C6Lix+Li1-xCoO2。下列有关说法不正确的是
A.锂离子电池与传统铅蓄电池相比,具有高比能量(比能量指的是单位重量或单位体积的能量)的特点
B.废旧锂离子电池先进行“放电处理”让Li+进入石墨(C6)中而利于回收
C.放电时,正极锂的化合价未发生改变
D.充电时电池正极上发生的反应为:LiCoO2—x e-=== Li1-x CoO2+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表中的一部分,表中所列字母分别代表一种化学元素,请回答下列问题:

(1)写出j在周期表中的位置__________。
(2)o、i、p三种元素之间能以原子个数之比1∶1两两形成互化物,这些互化物的性质类似于这些元素单质的性质。请写出i、p的互化物与f、l形成的化合物等物质的量反应时的化学方程式:_____________________________。
(3)假设NH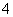 是“元素NH4”的阳离子,则“元素NH4”在周期表中的位置应该是______________;NH4的碳酸盐应________(填“易”或“不易”)溶于水。
是“元素NH4”的阳离子,则“元素NH4”在周期表中的位置应该是______________;NH4的碳酸盐应________(填“易”或“不易”)溶于水。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
①具有规则几何外形的固体一定是晶体
②含有阳离子的晶体一定是离子晶体
③非极性分子中一定含有非极性键
④s﹣s σ键与s﹣p σ键的电子云形状相同
⑤含有共价键的晶体一定具有高的熔、沸点及硬度
⑥因为H﹣F的键能大于H﹣Cl的键能,所以HF的沸点高于HCl
⑦含有π键的化合物与只含σ键的化合物的化学性质不同
⑧中心原子采取sp3杂化的分子,其立体构形不一定是正四面体.
A. ①②⑤⑥ B. ③⑦⑧ C. ⑦⑧ D. ③④⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
下面的表格是元素周期表的一部分,其中的序号对应的是元素.
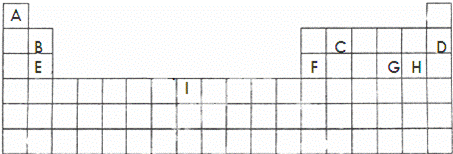
请回答下列问题:
(1)按原子轨道的重叠方式看,元素A、C形成的相对分子质量最小的分子含 键;元素E和H形成的化学键类型为 .
(2)上表中所列举的某元素最外电子层上p电子数比s电子数少1,则该元素的元素符号为
(3)B、D、E、F四种元素的第一电离能由大到小的顺序是(填元素符号) .
(4)元素I的价电子排布式为 .I元素通常情况下能形成两种离子,其中较稳定的是Fe3+,其原因是 .
(5)硒(se)是人体必需的微量元素,与G同一主族,Se原子比G原子多一个电子层.则:Se的原子序数为34,其原子结构示意图为 .
(6)G、H两元素能形成G2H2,它是一种琥珀色液体,是合成硫化染料的重要原料.它的熔点﹣80℃,沸点138℃.常温下,它遇水易反应,产生使品红褪色的气体,且溶液出现浑浊.
①S2Cl2遇水反应产生气体,该气体分子是 (填“极性”或“非极性”)分子.
②写出二氯化硫与水反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
|
| A. | 煤的干馏、石油分馏和裂化都是物理变化 |
|
| B. | 乙醇可以与水任意比例混溶,是因为乙醇与水形成了氢键 |
|
| C. | 某有机物燃烧只生成CO2和H2O,则该有机物一定只含有碳和氢两种元素 |
|
| D. | 不存在两种邻二甲苯,因此现代结构理论认为苯分子中碳碳键不是单双键交替 |
查看答案和解析>>
科目:高中化学 来源: 题型:
月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为________。
(2)Na的原子结构示意图为________,Na在氧气中完全燃烧所得产物的电子式为________。
(3)MgCl在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点________(填“高”或“低”)。
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为__________________________;SiO2的晶体类型为________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为________________(写化学式)。
(4)月壤中含有丰富的3He,从月壤中提炼1 kg 3He,同时可得6000 kg H2和700 kg N2,若以所得H2和N2为原料经一系列反应最多可生产碳酸氢铵________kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com