
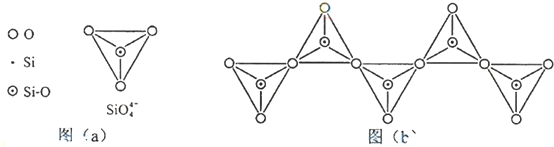
 ;
;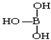 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:H3BO3+H2O?H4BO4-+H+.
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:H3BO3+H2O?H4BO4-+H+.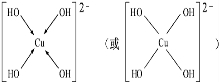 .
. 分析 (1)H3PO2是一元中强酸,能和NaOH发生中和反应生成盐和水;NaH2PO2由酸根离子和钠离子构成,属于正盐;
(2)①根据价层电子对互斥理论判断原子杂化方式;
②路易斯结构式要标出孤电子对和共用电子对;
③硼酸分子中B原子含有空轨道,与水电离出的氢氧根离子形成配位键形成B(OH)4-,同时产生1个H+;
(3)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键.
解答 解:(1)H3PO2是一元中强酸,能和NaOH发生中和反应生成盐和水且二者以1:1反应,反应方程式为H3PO2+OH-=H2PO2-+H2O;NaH2PO2由酸根离子和钠离子构成,属于正盐;
故答案为:H3PO2+OH-=H2PO2-+H2O;正盐;
(2)①该离子中每个Si原子价层电子对个数都是4,所以Si原子采用sp3杂化,故答案为:sp3;
②路易斯结构式要标出孤电子对和共用电子对,则二氧化碳路易斯结构式为 ,故答案为:
,故答案为: ;
;
③硼酸分子中B原子含有空轨道,与水电离出的氢氧根离子形成配位键形成B(OH)4-,同时产生1个H+,离子方程式为H3BO3+H2O?H4BO4-+H+,故答案为:H3BO3+H2O?H4BO4-+H+;
(3)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键,可表示为 ,故答案为:
,故答案为: .
.
点评 本题考查离子方程式的书写、配合物的成键情况、原子杂化方式判断等知识点,这些都是高频考点,知道价层电子对个数的计算方法,注意配位键的构成条件及表示方法,为易错点.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,c(Cl-)>c(NH${\;}_{4}^{+}$)>c(OH-)>c(H+) | |
| B. | 10mL0.1mol/L NH4Cl溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10mL0.5mol/LCH3COONa溶液与6mL 1mol/L盐酸混合,c(Na+)=c(Cl-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度 时间(s) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热(t1℃) | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热(t2℃) | 360(a) | 480 | 540 | 720 |
| MnO2催化剂、加热(t2℃) | 10(b) | 25 | 60 | 120 |
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从整个循环来看,利用该方法得到的氢能来源于太阳能 | |
| B. | 上述制氢气的化学方程式可表示为:(C6H10O5)n+7nH2O$\stackrel{酶}{→}$ 6nCO2↑+12nH2↑ | |
| C. | 氢元素的三种同素异形体${\;}_{1}^{1}H$、${\;}_{1}^{2}H$、${\;}_{1}^{3}H$,能形成六种单质 | |
| D. | 从化学的本质看该反应属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com