
【题目】下表中评价合理的是
选项 | 化学反应及其离子方程式 | 评价 |
A | Fe3O4与稀硝酸反应: 2Fe3O4+18H+===6Fe3++H2↑+8H2O | 正确 |
B | 向碳酸镁中加入稀盐酸: CO | 错误,碳酸镁不应写成离子形式 |
C | 向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO | 正确 |
D | FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2 | 错误,Fe2+与Br-的化学计量数之比应为1∶2 |
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)下列物质中,能导电的是 ,属于电解质的是 (填序号)。
①氨气、②氨水、③NH3·H2O、④硫酸溶液、⑤干冰、⑥BaSO4、⑦金刚石
(2)将等物质的量的①Na、②Na2O、③Na2O2、④NaOH投入相同质量的水中,所得溶液浓度由大到小的顺序为 。如果将等物质的量换成等质量则 。(填序号)
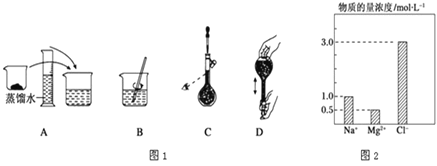
(3)如图表示某同学配制480mL 0.5mol/L 的NaOH溶液的部分操作示意图,其中有错误的是___________,这样操作所配制的溶液比要求的浓度要___________ (填“偏高”、“偏低”、“不影响”)。配制应称取___________gNaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
阳离子 | K+、Ag+、Mg2+、Ba2+ |
阴离子 | NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 在Ⅱ的滤液中滴加BaC12溶液 | 无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“不能确定”)
阴离子 | NO3- | CO32- | SiO32- | SO42- |
c/mol·L-1 |
(4)判断K+是否存在,若存在求其最小浓度(若不存在说明理由) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙醛(CH3CHO)和新制氢氧化铜的反应如下:
CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
某实验小组做上述反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2 mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1 mL | 1 mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2 mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1 mL | 3 mL | 蓝紫色溶液 | 12~13 | ———— |
(1)上表中a、b应为 (填字母序号)。
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4反应的化学方程式 。基于实验1、2的现象可以得出结论:NaOH用量较少时, 。
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其理论依据是 。
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是 。
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4] 2-),由此提出问题:[Cu(OH)4] 2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是 。基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.雷雨天气时空气中能生成少量的氮氧化物
B.实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气
C.铵盐化学性质都很稳定
D.O2、NO、NO2都能用浓硫酸干燥,且通常情况下能共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)= C(g) △H=△H1 D(g)+B(g)= E(g) △H=△H2,若A和D混合气体1mol完全与B反应,放热△H3,则A和D物质的量之比是
A. (△H2-△H3):(△H1-△H3) B. (△H3-△H2):(△H1-△H3)
C. (△H3-△H2):(△H3-△H1) D. (△H1-△H3):(△H3-△H1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其化合物有着广泛用途。工业上以菱镁矿(主要成分为MgCO3,含SiO2以及少量FeCO3等杂质)为原料制备纳米氧化镁的实验流程如下:
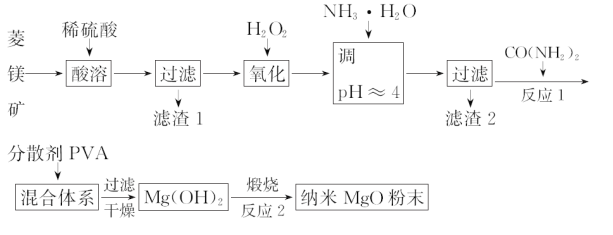
(1)滤渣1为______________________。
(2)加入H2O2氧化时,发生反应的离子方程式为______________________。
(3)在实验室煅烧滤渣2制得的金属氧化物为____________(填化学式),需要的仪器除酒精灯、三脚架、泥三角以外,还需要______________(填名称)。
(4)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,该反应中反应物的质量之比为________。
(5)25℃时,加入CO(NH2)2至开始产生沉淀,当Mg2+全部沉淀时溶液的c(OH-)=__________(已知25℃,Ksp[Mg(OH)2]=1.96×10-11)。
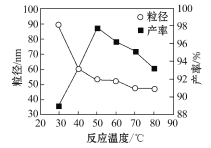
(6)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制备 纳米MgO。取少量制得的该物质溶于某种液体溶剂中(两者不反应),能说明是纳米MgO存在的简单方法是____________。如图为反应温度对纳米MgO产率和粒径的影响,据图分析反应的最佳温度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100ml溶液可能含有Na+、NH4+、Fe3+、 CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)

下列说法不正确的是
A.原溶液一定存在CO32-和SO42-,一定不存在Fe3+
B.原溶液一定存在Cl-,可能存在Na+
C.原溶液中c(Cl-) ≥0.1mol·L-1
D.若原溶液中不存在Na+,则c(Cl-)<0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为不是健康文明的生活方式的是( )
A. 不偏食,注意营养均衡 B. 每天坚持适度锻炼
C. 沉迷网络聊天、游戏 D. 不吸烟、不酗酒,远离毒品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com