
可以鉴别C2H5OH、C6H5OH、AgNO3、Na2CO3、氢硫酸五种物质的一种试剂是( )
A.稀盐酸 B.氢氧化钠溶液
C.FeCl3溶液 D.高锰酸钾溶液
 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
常温常压下为无色液体,而且密度大于水的是
①苯②硝基苯③溴苯④溴乙烷⑤正己烷⑥四氯化碳⑦CH3Cl⑧丁烯⑨甲苯
A.②③④⑥; B.②③④⑥⑨; C.①②③④⑤⑥⑨; D.②③⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
元素W、X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4,M原子的最外层电子数与次外层电子数之比为3∶4,且M原子的质子数是Y原子的2倍;X元素的最高正价与最低负价绝对值之差为2;N-、Z+、W+的半径逐渐减小;化合物WN常温下为气体,据此回答下列问题:
(1)W与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:_________________________________________。
(2)下图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:_________________。

(3)A、B均为由上述六种元素中的三种元素组成的强电解质,且组成元素的原子个数之比均为1∶1∶1。若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为________,B的电子式是________。
(4)XY2与H2O反应的离子方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:
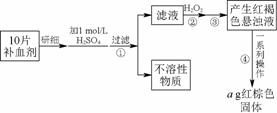
图95
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加____________,该过程的现象为________________________。
(2)步骤②加入过量H2O2的目的是________________________________________________________________________
________________________________________________________________________。
(3)步骤③中反应的离子方程式是________________________________________________________________________
________________________________________________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、________________________________________________________________________、
灼烧、________、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
A~G是几种烃的分子球棍模型,据此回答下列问题:

(1)常温下含碳量最高的气态烃是(填对应字母)________;
(2)能够发生加成反应的烃有(填数字) ________种;
(3)一卤代物种类最多的是(填对应的字母) ________;
(4)写出C发生加聚反应的化学方程式________;
(5)写出G合成烈性炸药(TNT)的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)右图所示的原电池装置中,其负极材料是 ,正极上能够观察到的现象是 ,正极的电极反应式是 。
原电池工作一段时间后,若消耗锌6.5g,则放出气体__________g。
(2)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为PbO2+Pb+2H2SO4===2PbSO4+2H2O,据此判断:铅蓄电池的负极材料是________。工作时,电解质溶液的酸性________(填“增大”、“减小”或“不变”)。工作时,电解质溶液中阴离子移向_______极(填“正”或“负”)。电子流动方向为从_______极流向_______极(填“正”或“负”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
氯元素的相对原子质量为35.5,氯只有35Cl和37Cl两种稳定同位素,在氯气中35Cl和37Cl的原子个数比为3∶1,则相对分子质量为70,72,74的氯气分子数之比可能是( )
A.5∶3∶2 B.5∶2∶2
C.5∶2∶1 D.9∶3∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com