
已知:CO(g)+H2O(g)  CO2(g)+H2(g) H=—41 kJ/mol
CO2(g)+H2(g) H=—41 kJ/mol
相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中,不正确的是
A.容器①中反应达平衡时,CO的转化率为80%
B.容器①中CO的转化率等于容器②中CO2的转化率
C.容器①中CO反应速率等于H2O的反应速率
D.平衡时,两容器中CO2的浓度相等
科目:高中化学 来源:2014-2015学年宁夏银川市、石嘴山市高三四月联考理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的数值,下列说法正确的是
A.常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA
B.常温下,pH=12的Na2CO3溶液中含有的OH-离子数为0. 01NA
C.标准状况下,0.56 L丙烷中含有共价键的数目为0.2 NA
D.7.8 g Na2O2中含有的阴离子数为0.2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通、扬州、连云港高三第二次调研测试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法中正确的是
A.常温常压下,2.24 L H2O中含有极性共价键的数目为0.2 NA
B.0.1 mol·L-1 NH4Cl溶液中含有NH4+的数目小于0.1 NA
C.100 mL 12 mol·L-1的浓HNO3与过量Cu反应转移电子的数目为0.6 NA
D.标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春市高三质量监测三理综化学试卷(解析版) 题型:选择题
异戊烷的二氯代物的同分异构体有
A.6种 B.8种 C.10种 D.12种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三四月调研考试理综化学试卷(解析版) 题型:实验题
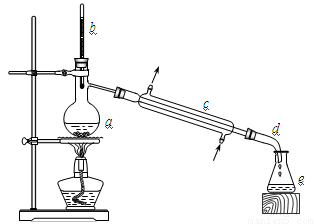
(13分)实验室利用冰醋酸和正丁醇制备乙酸正丁酯,实验装置如下图所示,可能用到的有关数据如下表:
正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 | |
密度/(g/cm3) | 0.810 | 1.049 | 0.882 | 0.7689 |
沸点/℃ | 118.0 | 118.1 | 126.1 | 142 |
合成反应:在干燥的a中加入9.32 g正丁醇、7.2 mL 冰醋酸和3~4滴浓硫酸,摇匀后,加几粒沸石,c中通水,开始缓慢加热,控制馏出物的温度不超过130℃。
分离提纯:①将仪器a中反应后的混合液与仪器e中的馏出物合并,转入分液漏斗中;②依次用水、少量的10%碳酸钠溶液和水洗涤,分离后再加干燥剂M,静置一段时间后,弃去M;③将最终得到的反应粗产物转入洗净的仪器a中,加入几粒沸石,进行蒸馏,得到乙酸正丁酯7.31 g。
请回答下列问题:
(1)仪器a的名称是_____________。
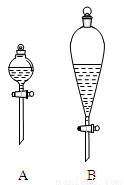
(2)在分液时应选如图装置中的____(填序号),使用该仪器前应先___。
(3)写出制备乙酸正丁酯的化学方程式:_______________________。
(4)第一次水洗的目的是____________________________。
(5)干燥剂M可以是_______(填序号)
A.五氧化二磷 B.无水硫酸钠
C.碱石灰 D.氢氧化钠固体
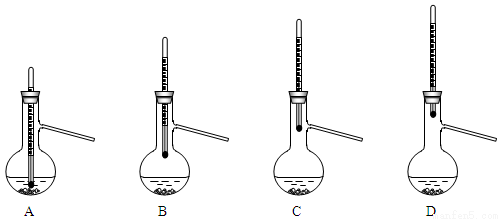
(6)步骤③得到的粗产品蒸馏提纯时,下图所示装置中,温度计位置可能导致收集到的产品中混有高沸点杂质的装置为______(填序号)
(7)本实验所得到的乙酸正丁酯的产率是__________(填序号)
A.30% B.40% C.50% D.55%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
[化学──选修2 :化学与技术](15分)工业上以黄铁矿(FeS2)为原料,采用接触法生产硫酸的流程图如下。
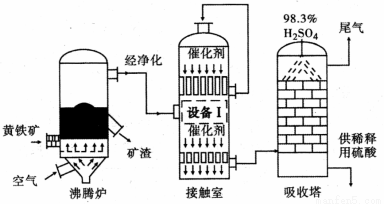
(1)黄铁矿在沸腾炉中反应的化学方程式为 。
(2)为充分利用反应放出的热量,接触室中应安装 (填“设备Ⅰ ”的名称)。
(3)原料气在一定条件下通入接触室中,测量各截面过程气体流中各种气体的物质的量的百分含量如下,则该过程中SO2的平衡转化率为 (精确到 0. l )。
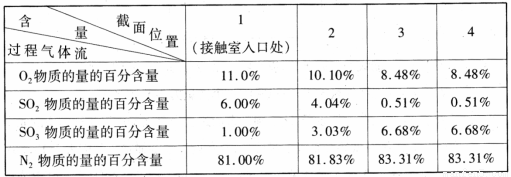
(4)在吸收塔中将SO3转化成硫酸,使用98.3 %的硫酸从上方喷淋,而不使用水的理由是 。吸收塔中填充有许多瓷管,其作用是 。
(5)尾气中常含有N2、O2 、SO2、微量的SO3等。为了综合利用尾气,可将其通人氨水中,再按一定比例加人碳酸氢铵,降低温度析出含结晶水的晶体。已知该结晶水合物的相对分子质量为134 , 则其化学式为 。
(6)能用于测定硫酸尾气中SO2含量的是 (填标号)。
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
X、Y、Z、W是原子序数依次增大的四种短周期元素.其中只有一种是金属元素,X、W同主族且能形成一种离子化合物WX;Y的气态氢化物、最高价氧化物的水化物可反应生成一种盐;Z原子的最外层电子数与其电子总数之比为3︰4。下列说法中正确的是
A.原子半径:W>Z>Y>X
B.氢化物稳定性:Y>Z
C.WY3中只有离子键没有共价键
D.X与Z可形成l0电子分子和18电子分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市七校高三4月联考化学试卷(解析版) 题型:简答题
(共16分)Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用。
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H= kJ·mol-1。
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g)设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有:

①燃料电池即电源的N极的电极反应式为 _______________________ ;
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 。
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g) N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(N0)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:

①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____(保留小数点后三位)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 。(填序号)。
A.增加CO的量 B.加入催化剂
C.减小CO2的量 D.扩大容器体积
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:推断题
聚酯增塑剂G及某医药中间体H的一种合成路线如下(部分反应条件略去):
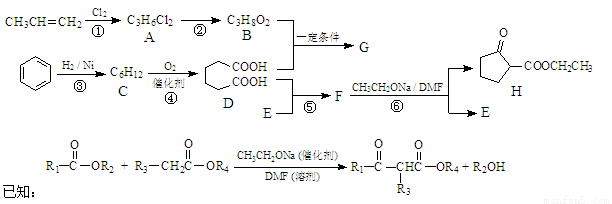
(1)B的名称(系统命名): ,D的分子式为 。
(2)反应①~⑥中属于取代反应的是 。
(3)G的结构简式为 。
(4)写出反应②和⑥的化学方程式:② ,⑥ 。
(5)C存在多种同分异构体,写出核磁共振氢谱只有两种峰的同分异构体的结构简式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com