
【题目】在标准状况下,ag气体A与bg气体B的分子数相同,下列说法中不正确的是( )
A.同温同压下A、B两气体的密度之比为a:b
B.同质量气体A与B的分子数之比为b:a
C.两种气体A与B的相对分子质量之比为b:a
D.相同状况下同体积A、B质量之比为a:b
【答案】C
【解析】
试题分析:A.ag气体A与bg气体B的分子数相同,即物质的量相同,物质的量相同的气体A、B在同温同压下体积也相同,由ρ=![]() =
=![]() 可知,气体的密度之比等于摩尔质量之比,即为a:b,故A正确;B.由n=
可知,气体的密度之比等于摩尔质量之比,即为a:b,故A正确;B.由n=![]() 可知,当质量相同时,n与M成反比,所以同质量气体A与B的分子数之比为b:a,故B正确;C.ag气体A与bg气体B的分子数相同,即物质的量相同,由M=
可知,当质量相同时,n与M成反比,所以同质量气体A与B的分子数之比为b:a,故B正确;C.ag气体A与bg气体B的分子数相同,即物质的量相同,由M=![]() 可知,当n相同时,M与m成正比,所以A、B的摩尔质量之比M(A) :M(B)=a :b;则A与B的相对分子质量之比为a:b,C错误;D.相同状况下,同体积的A与B的物质的量相同,则质量之比等于摩尔质量之比,即为a:b,故D正确。
可知,当n相同时,M与m成正比,所以A、B的摩尔质量之比M(A) :M(B)=a :b;则A与B的相对分子质量之比为a:b,C错误;D.相同状况下,同体积的A与B的物质的量相同,则质量之比等于摩尔质量之比,即为a:b,故D正确。
答案选C。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质在溶液中不发生化学反应而能共存的是( )
A.Na2SO4、KNO3、Na2CO3、NH4Cl B.H2SO4、BaCl2、Na2SO4、NaOH
C.MgCl2、AgNO3、KNO3、HCl D.NH4HCO3、NaOH、NaCl、HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在人体中的含量只有0.004%,微乎其微,但铁是组成血红蛋白的一个不可缺少的成员.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁,服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
(1)在人体中进行Fe2+![]() Fe3+的转化时,①中的Fe2+作 剂;
Fe3+的转化时,①中的Fe2+作 剂;
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作__________剂;
(3)用小苏打片(NaHCO3)治疗胃酸(主要成分盐酸)过多的离子方程式为 ;
如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
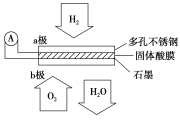
A.电子通过外电路从b极流向a极
B.H+由a极通过固体酸电解质传递到b极
C.b极上的电极反应式为:O2+2H2O+4e-=4OH-
D.每转移0.1 mol电子,消耗1.12 L的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其保持平衡,然后向左侧烧杯中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(不考虑两球的浮力变化)( )

A.杠杆为导体或绝缘体时,均为A端高B端低
B.杠杆为导体或绝缘体时,均为A端低B端高
C.当杠杆为导体时,A端高B端低
D.当杠杆为导体时,A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学元素的叙述,错误的是( )
A. 在你的身体中,含量最高的化学元素是O
B. 沙漠中仙人掌,含量最多的化合物和含量最多的有机物共有的元素是H和O
C. 组成蛋白质的元素都是大量元素
D. 活细胞中的主要元素是C、H、O、N、P、S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1) 可逆反应N2+3H2![]() 2NH3是工业上合成氨的重要反应
2NH3是工业上合成氨的重要反应
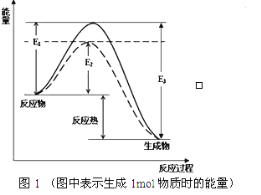
根据图1请写出合成氨的热化学方程式:_______________(热量用E1、E2或E3表示)。
(2)LiAlH4是一种重要的储氢载体,能与水反应达到LiAlO2和氢气,该反应消耗1mol LiAlH4时转移的电子数目为__________。
(3)氮化锂是非常有前途的储氢材料,其在氢气中加热中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2![]() LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_________%(精确到0.1)。
LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_________%(精确到0.1)。
(4)LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠,已知电池放电时总反应式为FePO4+Li═LiFePO4 ,电池正极反应为____________________。
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其它有机物)。
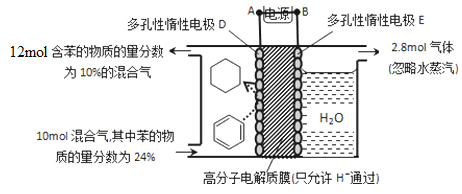
①导线中电子移动方向为____________。(用A、D表示)
②生成目标产物的电极反应式为__________________________。
③该储氢装置的电流效率![]() =__________________________。
=__________________________。
(![]() =
=![]() ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,有甲、乙两个密闭容器,甲容器的体积为1 L,乙容器的体积为2 L,分别向甲、乙两容器中加入6 mol A和3 mol B,发生反应如下:3A(g)+bB(g) ![]() 3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题:
3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题:
(1)甲容器中反应的平均速率v(B)=________。
(2)乙容器中反应达到平衡时所需时间t________4 min(填“大于”、“小于”或“等于”)。
(3)T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8 mol/L,起始时,向丙容器中加入C、D的物质的量分别为3 mol、2 mol,还需加入A、B。其中需加入A、B的物质的量分别是 _________________。
(4)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是____________。
A.保持温度不变,增大甲容器的体积至2 L
B.保持容器体积不变,使甲容器升高温度
C.保持容器体积和温度都不变,向甲中加入一定量的A气体
D.保持容器体积和温度都不变,向甲中加入一定量的B气体
(5) 该温度下,向体积为1L的密闭容器中通入A、B、C、D气体物质的量分别为3mol、1mol、3mol、2mol,此时反应___________________ (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com