
| A. | 某可逆反应达平衡状态时反应物和生成物共存 | |
| B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2+O2与2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O互为可逆反应 | |
| C. | 对于可逆反应,加入催化剂可使正逆反应速率均增大 | |
| D. | 提高可逆反应的限度可增加产量,从而提高经济效益 |
分析 A、根据可逆反应不能完全进行到底;
B、可逆反应,在同一条件下,既能向正反应方向进行,同时又能向逆反应的方向进行的反应;
C、催化剂同时改变正逆反应速率;
D、根据提高可逆反应的限度能够节约原料和能源、提高产品的产量、提高经济效益来回答.
解答 解:A、因为可逆反应不能完全进行到底,所以可逆反应达平衡状态时反应物和生成物共存,故A正确;
B、可逆反应是指在相同条件下,既能向正方向进行同时又能向逆方向进行的反应,2H2O$\frac{\underline{\;电解\;}}{\;}$2H2+O2与2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O条件不同,故B错误;
C、因为催化剂同时改变正逆反应速率,所以对于可逆反应,加入催化剂可使正逆反应速率均增大,故C正确;
D、提高化学反应的限度能够节约原料和能源、提高产品的产量、提高经济效益,故D正确;
故选B.
点评 本题考查了化学反应的限度与可逆反应,化学平衡的特点,难度不大,注意理解可逆反应的特征和化学反应的限度.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
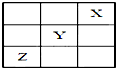 元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )
元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )| A. | X元素所在周期中所含非金属元素最多 | |
| B. | Y元素在周期表的第3周期ⅥA族 | |
| C. | Y元素基态原子的价电子排布为4s24p4 | |
| D. | Z元素基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气极易溶于水,所得的氨水中存在3种不同的氢键 | |
| B. | [Ag(NH3)2]+ 中含有6个σ键 | |
| C. | [Ag(NH3)2]OH所含有的化学键有离子键、极性共价键和配位键 | |
| D. | 在[Ag(NH3)2]+离子中Ag+给出孤对电子,NH3提供空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 C>D>B>A | B. | 原子序数 a>b>d>c | ||
| C. | 离子半径 A>B>D>C | D. | 元素失电子能力 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol | B. | 2.0 mol | C. | 3.0 mol | D. | 4.0 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  分离碘酒中 的碘和酒精 | B. | 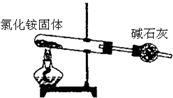 实验室制取氨气 | ||
| C. | 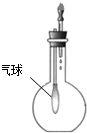 验证NH3的 溶解性 | D. | 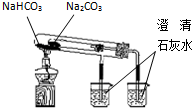 比较Na2CO3、NaHCO3的热稳定性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com