
| ��ѧ�� | H-H | C-O | C=O | H-O | C-H |
| E/��kJ•mol-1�� | 436 | 343 | 745 | 465 | 413 |
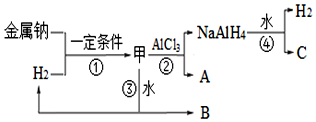
���� ��1����Ӧ�ȵ��ڷ�Ӧ����������������֮���ϸ�˹����ȷ����Ӧ���Լ�ƽ�ⳣ���Ĺ�ϵ��
��2�������ƺ�������Ӧ���ɼ�ΪNaH��NaH��ˮ��Ӧ����BΪNaOH�����Ȼ�����Ӧ����NaAlH4��NaCl��AΪNaCl��CΪNaAlO2���Դ˽����⣮
��� �⣺��1���ɱ������ݿ�֪��H1=��2��745+3��436��-��3��413+343+465+2��465��kJ•mol-1=-179kJ•mol-1���֡�H2=+41kJ•mol-1�����H3=��H1-��H2=-220kJ•mol-1����Ӧ��-�ڿɵ÷�Ӧ�ۣ���K3=$\frac{{K}_{1}}{{K}_{2}}$��
�ʴ�Ϊ��-220��$\frac{{K}_{1}}{{K}_{2}}$��
��2����AΪNaH������ʽΪNa+[��H]-��NaH��ˮ��Ӧ����NaOH������������ʽΪNaH+H2O=H2��+NaOH���ʴ�Ϊ��Na+[��H]-��NaH+H2O=H2��+NaOH��
��NaAlH4�ڴ����������ͷ���ʱ����Na3AlH6�����ֵ��ʣ����ֵ��ʷֱ�Ϊ������������÷�Ӧ�Ļ�ѧ����ʽΪ3NaAlH4=Na3AlH6+3H2��+2Al��
�ʴ�Ϊ��3NaAlH4=Na3AlH6+3H2��+2Al��
������Na��NaH������ˮ��Ӧ����H2������۲��������ʴ�Ϊ����������Na��NaH������ˮ��Ӧ����H2��
���� ������Ҫ�����Ϊ�ۺϣ��漰��Ӧ�����ʱ䡢ƽ�ⳣ���Լ�������ƶϣ�Ϊ�߿��������ͣ����ؿ���ѧ���ķ��������ͼ�����������Ŀƫ�ؿ��鳣��Ԫ���Լ��仯�����֪ʶ���ۺ��Խ�ǿ���ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | ����Ħ����� | C�� | Ħ�� | D�� | Ħ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��Ӧ����ȡ����Ӧ
��Ӧ����ȡ����Ӧ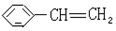 ʹ��ˮ��ɫ�ķ�Ӧ����ʽ
ʹ��ˮ��ɫ�ķ�Ӧ����ʽ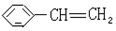 +Br2��
+Br2��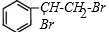 ��Ӧ���ͼӳɷ�Ӧ
��Ӧ���ͼӳɷ�Ӧ ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 150 mL 2 mol•L-1��NaCl | B�� | 75 mL 2 mol•L-1��NH4Cl | ||
| C�� | 150 mL 3 mol•L-1��KCl | D�� | 75 mL 2 mol•L-1��CaCl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �����Ҵ���Ŀ���ǽ����ܼ��ļ��ԣ���ʹ[Cu��NH3��4]SO4�������� | |
| B�� | ������ᄃ���У�N����λԭ�ӣ�NH3Ϊ�����Σ���λ����4 | |
| C�� | ��������Nԭ�����г�Ϊƽ�������Σ��ɼ�Cu2+��sp3�ӻ� | |
| D�� | ��þ����ˮ��Һ�м���ŨBaCl2��Һ�ް�ɫ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KOH��Al2��SO4��3 | B�� | NaOH��Ca��HCO3��2 | C�� | NaAlO2�� HCl | D�� | K2CO3��HNO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ٱ�ʾ2molC��s��ȼ������2molCO��g����Ҫ����221 kJ������ | |
| B�� | ̼��ȼ���ȴ���110.5 kJ/mol | |
| C�� | ϡ������ŨNaOH��Һ��Ӧ���к���Ϊ-57.3 kJ/mol | |
| D�� | ϡ������ϡNaOH��Һ��Ӧ����1 molˮ���ų�57.3 kJ���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com