
下列变化过程中,需要加入氧化剂的是( )
A.HCl→H2 B.Fe→FeCl3
C.CaCO3→CO2 D.浓H2SO4→SO2
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
下列有关实验的做法不正确的是( )
A.分液时,分液漏斗中的上层液体应由上口倒出
B.用加热分解的方法区分碳酸钠和碳酸氢钠两种固体
C.配制0.100 0 mol·L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流
D.检验NH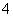 时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
以溴乙烷为原料制备1,2二溴乙烷,下列方案中最合理的是
( )
A.CH3CH2Br CH3CH2OH
CH3CH2OH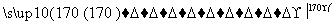
CH2===CH2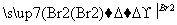 CH2BrCH2Br
CH2BrCH2Br
B.CH3CH2Br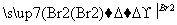 CH2BrCH2Br
CH2BrCH2Br
C.CH3CH2Br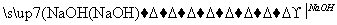 CH2===CH2
CH2===CH2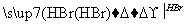 CH3CH2Br
CH3CH2Br
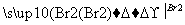 CH2BrCH2Br
CH2BrCH2Br
D.CH3CH2Br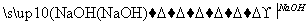 CH2===CH2
CH2===CH2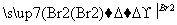 CH2BrCH2Br
CH2BrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酰水杨酸,又名邻乙酰氧基苯甲酸,是阿司匹林的主要成分。白色晶体或粉末,略有酸味,易溶于乙醇等有机溶剂,微溶于水,是常用的解热镇痛药。下面是某化学小组利用逆推法设计乙酰水杨酸合成路线的过程:
(1)查阅资料:
通过查阅资料得知:以水杨酸为原料合成乙酰水杨酸的反应为:
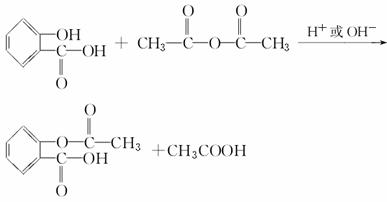
由苯酚制备水杨酸的途径:
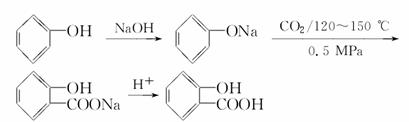
(2)实际合成路线的设计
①观察目标分子——乙酰水杨酸的结构。
乙酰水杨酸分子中有2个典型的官能团,即________、________。
②由目标分子逆推原料分子并设计合成路线。
首先,考虑酯基的引入,由水杨酸与乙酸酐反应制得;然后分头考虑水杨酸和乙酸酐的合成路线。其中,乙酸酐的合成路线为:_____________________。
根据信息和以前所学知识,水杨酸可以有以下几种不同的合成路线:
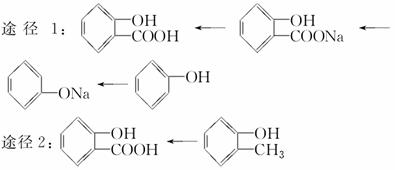
(3)优选水杨酸的合成路线
以上两种合成路线中较合理的为________;理由是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2→H2O IO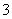 →I2
→I2
MnO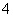 →Mn2+ HNO2→NO
→Mn2+ HNO2→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.H2O2 B.IO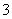
C.MnO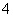 D.HNO2
D.HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
在Cl2、Fe2+、Mg、H2O、Cu2+中:
(1)只能做氧化剂的是________,实例:________。
(2)只能做还原剂的是________,实例:________。
(3)H2O作为氧化剂的反应实例:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各种说法中,正确的是( )
A.电离时生成的阳离子全部是氢离子的化合物一定是酸
B.所有的盐电离时只能生成酸根阴离子和金属阳离子。
C.氧化物是指含有氧元素的化合物,如NaOH、H2SO4等。
D.氨气溶于水溶液显碱性,所以氨气属于碱
查看答案和解析>>
科目:高中化学 来源: 题型:
将金属与金属(或非金属)加热熔合在一起就能形成合金。根据下列金属的熔点、沸点:
| Na | Cu | Al | Fe | |
| 熔点/℃ | 97.81 | 1083 | 660 | 1535 |
| 沸点/℃ | 882.9 | 2595 | 2467 | 3000 |
其中不能形成合金的是( )
A.Fe、Cu B.Fe、Al C.Cu、Na D.Al、Na
查看答案和解析>>
科目:高中化学 来源: 题型:
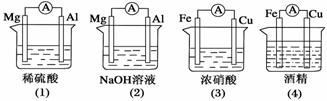
分析下图所示的四个装置,其中结论正确的是( )
A.(1)(2)中Mg作负极
B.(3)中Fe作负极,电极反应为Fe-2e-===Fe2+
C.(2)中Mg作正极,电极反应为6H2O+6e-===6OH-+3H2↑
D.(4)中Fe作负极,电极反应为Fe-2e-===Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com