
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
 N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有 | A.增加原催化剂的表面积 | B.降低温度 |
| C.减小投料比[n(NO2) / n(CH4)] | D.增大压强 |



科目:高中化学 来源:不详 题型:单选题
A.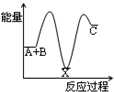 | B. | C.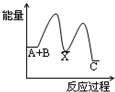 | D. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.485.5kJ/mol | B.610kJ/mol |
| C.917kJ/mol | D.1220kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.物质发生化学变化都伴随着能量变化 |
| B.任何反应中的能量变化都表现为热量变化 |
| C.伴有能量变化的物质变化都是化学变化 |
| D.即使没有物质的变化,也可能有能量的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.0~3 min,X的平均反应速率v(X)=0.2 mol·L-1·min-1 |
B.发生反应的方程式可表示为:3X(g)+Y(g)  2Z(g) 2Z(g) |
| C.保持其他条件不变,增大压强,平衡向正反应方向移动 |
| D.温度不变,增大X的浓度,该反应的平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表: | 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com