
对于反应:H2(g)+I2(g) 2HI(g),在一恒定压强的容器中进行,下列可以判断此反应达到平衡状态的是( )
2HI(g),在一恒定压强的容器中进行,下列可以判断此反应达到平衡状态的是( )
A.混合气体的体积保持不变 B.混合气体的密度保持不变
C.混合气体平均相对分子质量保持不变 D.混合气体颜色保持不变
D
【解析】
试题分析:可逆反应平衡状态的判断依据为: (1)“双向同时,符合比例”:反应速率必须一个是正反应的速率,一个是逆反应的速率,速率用不同物质表示时,速率之比等于方程式前的系数比;(2)“变量不变,已达平衡”:如果一个量随反应的进行而改变,当它不变时达到平衡状态;一个随反应的进行保持不变的量—恒量,不能作为是否是平衡状态的判断依据。对于反应:H2(g)+I2(g) 2HI(g),反应前后气体的物质的量和质量保持不变,在一恒定压强的容器中进行,根据阿伏加德罗定律及密度和摩尔质量的定义分析知,混合气体的体积、密度、相对分子质量均为恒量,不能作为是否是平衡状态的判断依据,混合气体颜色是由碘蒸气的浓度决定的,碘蒸气的浓度在反应前后为变量,当它不变时达到平衡状态,选D.
2HI(g),反应前后气体的物质的量和质量保持不变,在一恒定压强的容器中进行,根据阿伏加德罗定律及密度和摩尔质量的定义分析知,混合气体的体积、密度、相对分子质量均为恒量,不能作为是否是平衡状态的判断依据,混合气体颜色是由碘蒸气的浓度决定的,碘蒸气的浓度在反应前后为变量,当它不变时达到平衡状态,选D.
考点:考查可逆反应平衡状态的判断。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:北京市朝阳区2012届高三上学期期末考试化学试题 题型:013
|
已知一定条件下断裂或生成某些化学键的能量关系如下表:
对于反应:H2(g)+Cl2(g)=2HCl(g),下列说法正确的是 | |
| [ ] | |
A. |
该反应的反应热ΔH>0 |
B. |
生成1 mol HC1时反应放热431 kJ |
C. |
氢气分子中的化学键比氯气分子中的化学键更牢固 |
D. |
相同条件下,氢气分子具有的能量高于氯气分子具有的能量 |
查看答案和解析>>
科目:高中化学 来源:2014届北京市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.如图可表示水分解过程中的能量变化
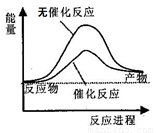
B.若2C(s)+O2(g)=2CO(g) △H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)=2HCl (g) △H=- a kJ/mol,
Ⅱ: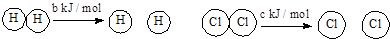
且a、b、c均大于零,则断开1molH-Cl键所需的能量为- a-b-c
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市海淀区高三上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.右图可表示水分解过程中的能量变化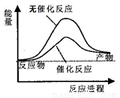
B.若2C(s)+O2(g)=2CO(g) △H= -221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)=2HCl (g) △H= - a kJ/mol,
Ⅱ: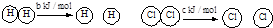
且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为- a-b-c kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com