
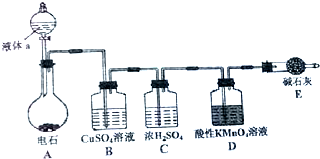
 如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.
如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.分析 (1)实验室制备乙炔利用碳化钙和水反应生成乙炔和氢氧化钙;
(2)电石与水反应速率太快,通常利用饱和食盐水代替水以减慢化学反应速率;
(3)此反应中会产生杂质气体硫化氢、磷化氢等,会对乙炔性质实验造成干扰,据此解答;
(4)乙炔含有碳碳三键,能与高锰酸钾溶液反应使其褪色;
(5)可燃性的气体与氧气混合,点燃易发生爆炸.
解答 解:(1)实验室制备乙炔利用碳化钙和水反应生成乙炔和氢氧化钙,反应为CaC2+2H2O→Ca(OH)2+C2H2↑,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)电石与水反应速率太快,通常利用饱和食盐水代替水以减慢化学反应速率,
故答案为:饱和食盐水;
(3)此反应中会产生杂质气体,硫化氢、磷化氢,会对乙炔性质实验造成干扰,利用硫酸铜溶液吸收硫化氢、磷化氢气体,以避免干扰,
故答案为:吸收杂质气体硫化氢、磷化氢等;
(4)乙炔含有碳碳三键,能与高锰酸钾溶液反应C2H2+2KMnO4+3H2SO4=K2SO4+2MnSO4+2CO2+4H2O,使其褪色,
故答案为:酸性KMnO4溶液褪色;
(5)可燃性的气体与空气混合,点燃易发生爆炸,所以需在点燃前验纯,
故答案为:验纯.
点评 本题考查了乙炔的制备和性质实验,题目难度不大,本题中注意乙炔的除杂和性质实验,注意与高锰酸钾溶液反应的性质.


科目:高中化学 来源: 题型:选择题
 常温下,向20mL0.2mol•L-1H2C2O4溶液中滴加0.2mol•L-1NaOH溶液.有关微粒物质的量的变化如图(其中I代表H2C2O4,Ⅱ代表HC2O4-,Ⅲ代表C2O42-),根据图示判断,下列说法正确的是( )
常温下,向20mL0.2mol•L-1H2C2O4溶液中滴加0.2mol•L-1NaOH溶液.有关微粒物质的量的变化如图(其中I代表H2C2O4,Ⅱ代表HC2O4-,Ⅲ代表C2O42-),根据图示判断,下列说法正确的是( )| A. | H2C2O4在水中的电离方程式是:H2C2O4?2H++C2O42- | |
| B. | 当V(NaOH)=20mL时,溶液中水的电离程度比纯水小 | |
| C. | 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+2c(HC2O4-)+3c(H2C2O4)═c(C2O42-)+2c(OH-) | |
| D. | 已知H2C2O4的电离常数分别为K1、K2,则a点的c(H+)=K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔气体中常含有杂质,通常采用硫酸铜溶液洗气除杂 | |
| B. | 为了加快此反应的反应速率,通常往水中加入少许盐酸 | |
| C. | 将生成的气体直接通往溴水中,溴水褪色则证明产生了乙炔 | |
| D. | 通常采取向上排空气法收集乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.8mol/L | B. | 1.8mol/L | C. | 2.4mol/L | D. | 4.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ | B. | SO42- | C. | MnO4- | D. | Mn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com