
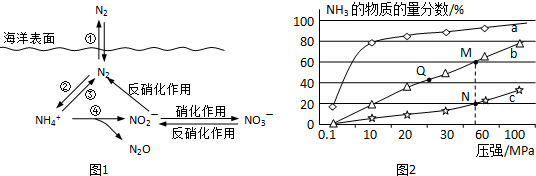
分析 Ⅰ.(1)氮的固定作用是指游离态氮元素发生反应生成化合态氮元素的过程为固氮作用,即单质变化为化合物;
(2)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,生成N2O、NO2-、H+和水,结合电荷守恒和原子守恒配平书写离子方程式得到;
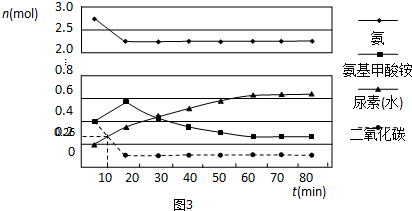
Ⅱ.(1)正反应是放热反应,升高温度平衡逆向移动,氨气的含量减小;
(2)A.减小生成物浓度平衡正向移动;
B.K只受温度影响,温度不变平衡常数不变,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
C.温度越高反应速率越快;
D.计算平衡时各组分浓度,代入K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$计算平衡常数;
Ⅲ.(1)已知:①2NH3(g)+CO2(g)═H2NCOONH4(s)△H=-272kJ•mol-1;
②H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H=+138kJ•mol-1;
根据盖斯定律,①+②可得:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s);
(2)已知总反应的快慢由慢的一步决定,反应快慢可以依据第一步和第二步反应的曲线斜率比较大小;
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气,电解时,阳极上发生氧化反应得到氧化产物,即为氮气,据此书写电极反应式.
解答 解:Ⅰ.(1)氮的固定作用是指游离态氮元素发生反应生成化合态氮元素的过程为固氮作用,即单质变化为化合物,分析转化关系图可知只有反应②是氮气保护为铵根离子是固氮作用,
故答案为:②;
(2)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,生成N2O、NO2-、H+和水,氮元素化合价-3价变化为+1价和+3价,氧元素化合价0价变化为-2价,电子转移总数20e-,所以铵根离子前为4,氧气前为5,NO2-前为2,N2O前为1,结合电荷守恒得到氢离子前为6,水分子式前为5,配平得到离子方程式为:4NH4++5O2═2NO2-+6H++N2O+5H2O,
故答案为:4,6,1N2O,5H2O;
Ⅱ.(1)合成氨的反应为放热反应,反应温度越高,越不利于反应正向进行,曲线a的氨气的物质的量分数最高,其反应温度对应相对最低,所以a曲线对应温度为200°C;
故答案为:200℃;
(2)A.及时分离出NH3,可以使平衡正向进行,可以提高H2的平衡转化率,故A正确;
B.平衡常数与温度有关,与其他条件无关,温度相同时平衡常数相同,反应是放热反应,温度越高平衡常数越小,则M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故B正确;
C.N点温度高于M点,温度越低反应速率越快,故N点比M点的反应速率快,故C错误;
D.N点时c(NH3)=0.2mol•L-1,氨气体积分数为20%,则:
N2(g)+3H2(g)?2NH3(g)
起始浓度(mol/L):x 3x 0
变化浓度(mol/L):0.1 0.3 0.2
平衡浓度(mol/L):x-0.1 3x-0.3 0.2
所以$\frac{0.2}{4x-0.2}$=20%,解得x=0.3,平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$=$\frac{0.{2}^{2}}{0.2×0.{6}^{3}}$≈0.93L2/mol2,故D正确;
故答案为:ABD;
Ⅲ.(1)已知:①2NH3(g)+CO2(g)═H2NCOONH4(s)△H=-272kJ•mol-1;
②H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H=+138kJ•mol-1;
根据盖斯定律,①+②可得:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s)△H=-134kJ/mol,
故答案为:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s)△H=-134kJ/mol;
(2)①由图象可知在15分钟左右,氨气和二氧化碳反应生成氨基甲酸铵后不再变化发生的是第一步反应,氨基甲酸铵先增大再减小最后达到平衡,发生的是第二步反应,从曲线斜率不难看出第2步反应速率慢,所以合成尿素总反应的快慢由第2步反应决定,根据图可知,尿素在55分钟时,物质的量不再变化,即反应达到平衡,所以总反应进行到55min时到达平衡,
故答案为:2;55;
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气,电解时,阳极上发生氧化反应得到氧化产物,即为氮气,电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,
故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
点评 本题考查化学平衡计算与影响因素、化学平衡图象、热化学方程式的书写、盐类水解等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学计算能力,题目难度中等.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 有机物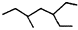 的系统命名为:3-乙基-5-甲基庚烷 的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质 | |
| C. | 等质量的丁烷、丁烯、1,3-丁二烯分别充分燃烧,所耗氧气的量依次增加 | |
| D. | 糖类、油脂、蛋白质都属于天然有机高分子化合物,都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
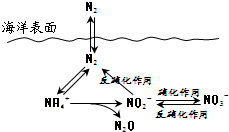
| A. | 反硝化作用中N元素均被氧化 | |
| B. | N元素所形成的化合物均易溶于水 | |
| C. | N2性质活泼可与多种物质发生反应 | |
| D. | 向海洋排放含NO3-的废水可能影响海洋中N元素循环 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
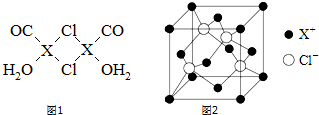
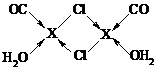 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | 最高价氧化物的水化物的碱性:A<C | |
| B. | B、D形成的化合物的溶于水形成B2D3溶液 | |
| C. | A、E形成的化合物只含离子键和极性键 | |
| D. | E的单质可以从D的氢化物中置换出D单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中常用的塑料制品及橡胶制品都为高分子材料 | |
| B. | 埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液、双氧水均可以将病毒氧化而达到消毒的目的 | |
| C. | 明矾和漂白粉常用于自来水的净化,但两者的作用原理不相同 | |
| D. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
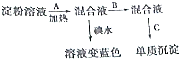
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、Cl-、CO${\;}_{3}^{2-}$ | B. | Na+、I-、Cl-、OH- | ||
| C. | NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、K+、OH- | D. | Na+、Al3+、SO${\;}_{4}^{2-}$、HCO${\;}_{3}^{-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com