
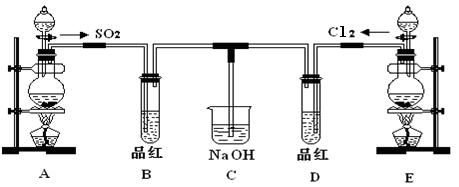
分析 (1)使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出;
(2)分析反应中各元素化合价变化,判断物质的性质;
①二氧化硫具有漂白性、氯气与水反应生成的次氯酸具有漂白性,都能够使品红褪色;
②SO2的漂白具有可逆性,次氯酸的漂白不可逆;
(3)氯气具有较强的氧化性,二氧化硫具有较强的还原性,在水溶液中两者发生反应Cl2+SO2+2H2O═2HCl+H2SO4.
解答 解:(1)塞子没有取下来,打开活塞时,空气无法进入分液漏斗内部,造成分液漏斗内的压强小于大气压强,液体无法流出,
故答案为:分液漏斗的玻璃塞没有取下来;
(2)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O反应中液体盐酸中氯化氢的-1价氯元素部分化合价升高为氯气中的0价,表现为还原性;部分化合价不变,表现为酸性;
故答案为:还原性、酸性;
①SO2具有漂白性,二氧化硫通入品红溶液中,品红褪色;氯气和水反应生成的次氯酸具有漂白性,因而氯气通入品红溶液中也能使品红褪色,
故答案为:品红褪色;品红褪色;
②SO2的漂白具有可逆性,褪色后的溶液加热时又恢复原来的红色;次氯酸的漂白不可逆,加热时,不能恢复红色,
故答案为:褪色的品红又恢复成红色;无明显现象;
(3)氯气具有较强的氧化性,二氧化硫具有较强的还原性,在水溶液中两者1:1发生反应:Cl2+SO2+2H2O═2HCl+H2SO4,生成物都无漂白性,因而SO2和Cl2按1:1同时通入到品红溶液时,品红溶液并不退色,
故答案为:Cl2+SO2+2H2O═2HCl+H2SO4.
点评 本题考查氯气和二氧化硫的漂白性质,题目难打中等,注意掌握氯气和二氧化硫性质,明确二氧化硫的漂白性与次氯酸的漂白性根本区别.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:填空题
(1)Al2(SO4)3水溶液呈____ (填“酸性”、“中性”或“碱 性”),原因是____ .(写离子方程式)
性”),原因是____ .(写离子方程式)
(2)NaHCO3水溶液呈____ (填“酸性”、“中性”或“碱性”),原因是 (写离子方程式)
(3)写出上述两溶液混合后的离子方程式是__
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子个数比为1:1 | B. | 原子个数比为5:4 | ||
| C. | 质量比为17:16 | D. | 氢原子个数比为4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O=2 NaOH+H2↑ | B. | Cl2+H2O=HCl+HClO | ||
| C. | CaCO3=CaO+CO2↑ | D. | Ca(ClO)2+2HCl=CaCl2+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .m+n>p△H>0 | B. | m+n<p△H>0 | C. | .m+n>p△H<0 | D. | m+n<p△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com