
 ,
, ;
;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和稀盐酸反应 2Fe+6H+=2Fe3++3H2↑ |
| B、碳酸钙溶于稀盐酸中 CO32-+2H+=CO2↑+H2O |
| C、碳酸氢钠溶液与盐酸反应 HCO3-+H+=CO2↑+H2O |
| D、氧化铜与盐酸反应 O2-+2H+=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
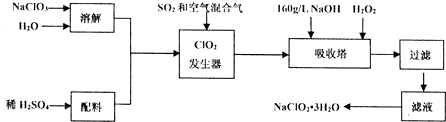
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,
,
查看答案和解析>>
科目:高中化学 来源: 题型:
 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.回答下列问题:| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
| 指示剂 | 变色范围 (pH) | 颜色 | |
| 酸色 | 碱色 | ||
| 甲基橙 | 3.1~4.4 | 红 | 黄 |
| 石蕊 | 5.0~8.0 | 红 | 蓝 |
| 酚酞 | 8.2~10.0 | 无 | 红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸乙酯的结构简式:CH3CH2COOCH3 |
B、2-甲基-2-戊烯的键线式: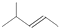 |
| C、乙醇的结构简式:CH3CH2OH |
| D、1,3-丁二烯的分子式:C4H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2b kJ?mol-1 | ||
B、C2H2(g)+
| ||
| C、2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-4b kJ?mol-1 | ||
| D、2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+b kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com