将3.9gMg、Al合金溶于一定物质的量浓度的HCl溶液400ml中,刚好完全反应,经检测合金和盐酸都无剩余,再向反应后的溶液中加入1mol/L的NaOH溶液后,生成沉淀,如果加入一定量的NaOH溶液后沉淀量最大时,溶液的总体积刚好为800ml,假设完全反应(不考虑体积变化),请求:
(1)生成的沉淀的最大值是多少?
(2)原合金中Mg的质量百分含量(计算结果保留一位小数点).
解:加入一定量的NaOH溶液后沉淀量最大时,溶液的总体积刚好为合金溶解时的体积的两倍,
即所用NaOH溶液的体积为800ml-400ml=400ml=0.4L,所以n(NaOH)=0.4L×1mol/L=0.4mol,
(1)根据Mg
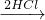
MgCl
2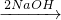
Mg(OH)
2,Al
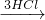
AlCl
3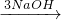
Al(OH)
3,
可知3.9gMg、Al合金最终得到的是Mg(OH)
2和Al(OH)
3沉淀,
则沉淀的质量m(氢氧化物)=m(合金)+m(OH
-),
根据转化关系式可知:n(OH
-)=n(NaOH)=0.4L×1mol/L=0.4mol,
m(OH
-)=0.4mol×17g/mol=6.8g,
所以沉淀的质量为m(氢氧化物)=m(合金)+m(OH
-)=3.9g+6.8g=10.7g,
答:生成的沉淀的最大值是10.7g.
(2)设3.9gMg、Al合金中Mg的物质的量为x,Al的物质的量为y,则
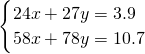
解之得:
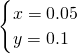
即:镁、铝的物质的量分别为0.05mol、0.1mol,
所以Mg的质量为0.05mol×24g/mol=1.2g,
质量分数为
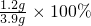
=30.8%,
答:原合金中Mg的质量百分含量为30.8%.
分析:加入一定量的NaOH溶液后沉淀量最大时,溶液的总体积刚好为合金溶解时的体积的两倍,
即所用NaOH溶液的体积为800ml-400ml=400ml=0.4L,
由Mg
MgCl
2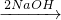
Mg(OH)
2,Al
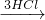
AlCl
3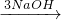
Al(OH)
3,根据关系式计算.
点评:本题考查混合物的计算,题目难度中等,注意关系式法和守恒法在解答中的重要应用,即可快速解答此题.

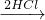 MgCl2
MgCl2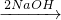 Mg(OH)2,Al
Mg(OH)2,Al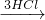 AlCl3
AlCl3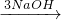 Al(OH)3,
Al(OH)3,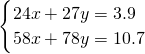
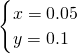
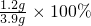 =30.8%,
=30.8%,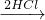 MgCl2
MgCl2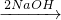 Mg(OH)2,Al
Mg(OH)2,Al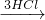 AlCl3
AlCl3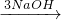 Al(OH)3,根据关系式计算.
Al(OH)3,根据关系式计算.
