
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+ H2O(g) 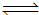 CO(g)
+H2(g) ΔH=
+131.3 kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是
。(填序号)
CO(g)
+H2(g) ΔH=
+131.3 kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是
。(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+ CO2(g)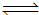 2CO(g)
△H=+172.5kJ•mol-1
2CO(g)
△H=+172.5kJ•mol-1
则CO(g)+H2O(g)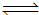 CO2(g)+H2(g)的焓变△H=
CO2(g)+H2(g)的焓变△H=
(3)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2(g)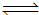 CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为:
。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为:
。
若用该电池提供的电能电解60mL NaCl溶液,设有0.01molCH3OH完全放电,NaCl足量,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
 CO(g)+H2O(g)
CO2(g)+H2(g),得到如下数据:
CO(g)+H2O(g)
CO2(g)+H2(g),得到如下数据:
|
温度/℃ |
起始量/mol |
平衡量/mol[学科 |
达到平衡所x需时间/min |
||
|
H2O |
CO |
H2 |
CO |
||
|
900 |
1.0 |
2.0 |
0.4 |
1.6 |
3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字) 。
改变反应的某一条件,反应进行到tmin时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)
 2NH3(g)
ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g)
ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
不同实验条件下反应,N2浓度随时间变化如下图1。


图1 图2
请回答下列问题:
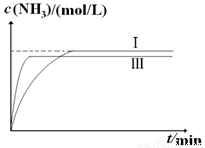
①与实验Ⅰ比较,实验Ⅱ改变的条件为 。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在上图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
(15分)(1)A D(2分) (2)-41.2kJ•mol-1 (2分)
(3)CH3OH(g) +H2O-6e-= CO2 +6H+ (2分)14(2分)
(4)
3CO2 + 5OH- = 2CO32- + HCO3- + 2H2O
(5)①使用催化剂(1分)。
②

(2分,纵坐标起点可以大于0。Ⅲ比Ⅰ快1分,比Ⅰ少1分)
【解析】
试题分析:⑴C(s)+ H2O(g) 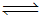 CO(g)
+H2(g) ΔH=
+131.3 kJ•mol-1,是吸热反应,升高温度平衡正向移动,A正确,增加碳的的用量不能增加反应物浓度,平衡不移动,B不正确,催化剂只加快反应速率,不能使平衡移动,C不正确,吸收剂吸收CO,减小生成物浓度,平衡正向移动,D正确,选A D。⑵根据盖斯定律:①C(s)+ H2O(g)
CO(g)
+H2(g) ΔH=
+131.3 kJ•mol-1,是吸热反应,升高温度平衡正向移动,A正确,增加碳的的用量不能增加反应物浓度,平衡不移动,B不正确,催化剂只加快反应速率,不能使平衡移动,C不正确,吸收剂吸收CO,减小生成物浓度,平衡正向移动,D正确,选A D。⑵根据盖斯定律:①C(s)+ H2O(g) 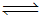 CO(g)
+H2(g) ΔH=
+131.3 kJ•mol-1,②C(s)+ CO2(g)
CO(g)
+H2(g) ΔH=
+131.3 kJ•mol-1,②C(s)+ CO2(g)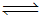 2CO(g)
△H=+172.5kJ•mol-1,①―②得:CO(g)+H2O(g)
2CO(g)
△H=+172.5kJ•mol-1,①―②得:CO(g)+H2O(g)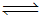 CO2(g)+H2(g)ΔH=―41.2kJ•mol-1 ,答案:―41.2kJ•mol-1。⑶甲醇燃料电池,甲醇作还原剂,在负极上发生氧化反应,用稀硫酸作电解质溶液,电极反应为:CH3OH(g) +H2O-6e-=
CO2 +6H+ 。2NaCl+2H2O
CO2(g)+H2(g)ΔH=―41.2kJ•mol-1 ,答案:―41.2kJ•mol-1。⑶甲醇燃料电池,甲醇作还原剂,在负极上发生氧化反应,用稀硫酸作电解质溶液,电极反应为:CH3OH(g) +H2O-6e-=
CO2 +6H+ 。2NaCl+2H2O 2NaOH+H2↑+Cl2↑,
CH3OH(g) ~ 6e- ~ 6NaOH,0.01molCH3OH完全放电,生成0.06molNaOH,c(OH―)= 0.06mol/0.06L=1mol/l,pH=-lg c(H+ )= -lg
10-14=14.答案:CH3OH(g) +H2O-6e-=
CO2 +6H+ 、 14;⑷
2NaOH+H2↑+Cl2↑,
CH3OH(g) ~ 6e- ~ 6NaOH,0.01molCH3OH完全放电,生成0.06molNaOH,c(OH―)= 0.06mol/0.06L=1mol/l,pH=-lg c(H+ )= -lg
10-14=14.答案:CH3OH(g) +H2O-6e-=
CO2 +6H+ 、 14;⑷
平衡常数为
n(CO2)=0,6mol;n(OH-)=0.2ml×5mol·L-1=1mol;
CO2+2OH-=CO32-+H2O;CO2+OH-=HCO3-;
依据反应n(CO2):n(OH-)=0.6:1=3:5可知反应生成产物有碳酸钠和碳酸氢钠,根据物质的量之比,利用直平法得到离子方程式:3CO2+5OH-=2CO32-+HCO3-+2H2O;
故答案为:0.17 和3CO2+5OH-=2CO32-+HCO3-+2H2O;
⑸①N2(g)+3H2(g)  2NH3(g)
ΔH=-92.4kJ•mol-1,为体积减小的反应,与实验Ⅰ比较,平衡不移动,不可能是改变压强,又反应速率加快,实验Ⅱ改变的条件为使用催化剂。答案:使用催化剂;
2NH3(g)
ΔH=-92.4kJ•mol-1,为体积减小的反应,与实验Ⅰ比较,平衡不移动,不可能是改变压强,又反应速率加快,实验Ⅱ改变的条件为使用催化剂。答案:使用催化剂;
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,速率加快,平衡逆向移动,实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图
考点:考查了反应能量守恒的分析判断,化学平衡三段式计算方法,转化率的计算应用,平衡影响因素,平衡移动原理的应用,热化学方程式的书写,反应产物判断的计算应用,题目难度中等.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所x需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
| 一定条件 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 起始浓度mol/L | 平衡浓度mol/L | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
查看答案和解析>>
科目:高中化学 来源:2013届广东省佛山一中高三第二次段考化学试卷(带解析) 题型:填空题
(13分)碳及其化合物有广泛的用途。
(1)写出用碳棒作电极电解饱和食盐水的离子方程式: 。 (2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
(2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
 (3)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
(3)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
 2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。

查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省高三第二次段考化学试卷(解析版) 题型:填空题
(13分)碳及其化合物有广泛的用途。
(1)写出用碳棒作电极电解饱和食盐水的离子方程式: 。
 (2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g)
CO(g)+H2(g)
(2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g)
CO(g)+H2(g)
ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
 (3)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
(3)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
|
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
|
H2O |
CO |
H2 |
CO |
||
|
900 |
1.0 |
2.0 |
0.4 |
1.6 |
3.0 |
通过计算求出该反应的平衡常数(写出计算过程,结果保留两位有效数字)。
(4)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。

请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为 ,判断依据是 。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在下图中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com