
| A. | ②④③⑥①⑤ | B. | ②④③⑥⑤① | C. | ②⑤③⑥①④ | D. | ②⑤①③⑥④ |
分析 检验卤代烃中所含有的卤素原子,先使卤代烃中的卤素原子变为卤离子,在氢氧化钠水溶液中水解生成卤离子,再加入硝酸酸化,最后加入硝酸银,观察是否沉淀生成及颜色,确定含有的卤素原子,以此来解答.
解答 解:鉴定卤代烃中所含有的卤素原子,先②加入少许卤代烃试样、再④加入5mL 4mol/L NaOH溶液,然后③加热,发生水解反应生成卤素离子,冷却后再⑤加入5mL 4mol/L HNO3溶液,最后①加入AgNO3 ,观察沉淀及其颜色可确定卤素原子,
故选B.
点评 本题考查有机物的中卤素原子检验,为高频考点,注意溴乙烷中不含溴离子,明确卤离子的转化是解答的关键,水解后加酸至酸性为解答的易错点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
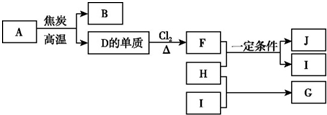 化合物A是制玻璃的主要原料之一.常温下,化合物B、H、I为气体,B不溶于水,H、I易溶于水,H的水溶液呈碱性,I的水溶液呈酸性.D元素是地壳中含量仅次于氧的非金属元素.化合物J是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中D元素的质量分数为60%.上述物质间的转化关系如图所示.
化合物A是制玻璃的主要原料之一.常温下,化合物B、H、I为气体,B不溶于水,H、I易溶于水,H的水溶液呈碱性,I的水溶液呈酸性.D元素是地壳中含量仅次于氧的非金属元素.化合物J是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中D元素的质量分数为60%.上述物质间的转化关系如图所示. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在电离只有HCO3-?H++CO32-,H2O?H++OH- | |
| B. | HCO3-的电离程度大于HCO3-的水解程度 | |
| C. | c (Na+)+c (H+)═c (HCO3-)+c (CO32-)+c (OH-) | |
| D. | c (Na+)═c (HCO3-)+c (CO32-)+c (H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X可用新制的氢氧化铜检验 | B. | Y有同分异构体 | ||
| C. | M含有两种碳氧共价键 | D. | Y可发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,44 g的N2O和CO2混合气体含有的分子数为NA | |
| B. | 1 mol Fe粉与1 mol水蒸气充分反应转移的电子数为2NA | |
| C. | 标准状况下,1 L乙醇完全燃烧产生CO2分子的数目为$\frac{{N}_{A}}{22.4}$×2 | |
| D. | 1 mol CH3+中含有电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HClO都是弱酸,HClO3、HClO4均为强酸 | |
| B. | HBr的水溶液有酸性、氧化性、还原性 | |
| C. | HI的水溶液还原性很强,在空气中易被氧化变质 | |
| D. | HX水溶液酸性顺序为:HCl>HBr>HI>HF |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
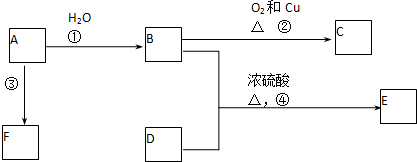

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com