
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42﹣和泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液,正确的操作顺序是( )
A.①④②⑤③
B.④①②⑤③
C.②⑤④①③
D.④⑤②①③
科目:高中化学 来源: 题型:
【题目】下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa):
①C4H10(g)+![]() O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
②C4H10(g)+![]() O2(g)===4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
O2(g)===4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
③C4H10(g)+![]() O2(g)===4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
O2(g)===4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
④C4H10(g)+![]() O2(g)===4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
O2(g)===4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
由此判断,正丁烷的燃烧热是
A. ΔH=-2 878 kJ·mol-1 B. ΔH=-2 658 kJ·mol-1
C. ΔH=-1 746 kJ·mol-1 D. ΔH=-1 526 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭体系中,可逆反应:A(s)+2B(g)![]() 2C(g);ΔH<0,不能作为该反应达到化学平衡的标志的是( )
2C(g);ΔH<0,不能作为该反应达到化学平衡的标志的是( )
①v正(B)=v逆(C) ②n(B)∶n(C)=1∶1 ③容器内压强不再改变 ④容器内气体的密度不再改变 ⑤容器内混合气体的平均相对分子质量不再改变
A.②③④⑤ B.②③
C.①③④ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.氯水中有下列平衡Cl2+H2O![]() HCl+HClO,光照后,溶液颜色变浅
HCl+HClO,光照后,溶液颜色变浅
B.合成氨反应,为提高氨的产率,理论上应采取较低的温度
C.用饱和食盐水除去Cl2中的HCl
D.反应2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373 K时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol/L。在60 s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是( )
A.前2 s,以N2O4浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
B.在2 s时,体系内压强为反应前的1.1倍
C.平衡时,体系内含N2O4 0.25 mol
D.平衡时,若往容器内充入氮气,则可提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的描述不正确的是
A.SiO2可用于制造光导纤维
B.H2SiO3可以用二氧化硅和水反应制得
C.普通玻璃是以纯碱、石灰石和石英为原料制成的
D.盛装NaOH溶液的试剂瓶不用玻璃塞是因为玻璃塞与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.能在水溶液或熔融状态下导电的物质是电解质
B.电离出氢离子的化合物是酸
C.氧化还原反应中转移电子数等于得电子数与失电子数加和
D.丁达尔效应可用来区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂。已知Na2FeO4在强碱性溶液中会析出沉淀。其生产工艺流程如图所示:
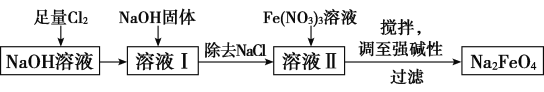
(1)写出向NaOH溶液中通入足量Cl2发生反应的离子方程式:_________________________。
(2)向溶液Ⅱ中加入Fe(NO3)3溶液发生反应,该反应的氧化剂是____________,每制得49.8 g Na2FeO4,理论上消耗氧化剂的物质的量为____________mol。
(3)从环境保护的角度看,制备Na2FeO4较好的方法为电解法,其装置如图甲所示。
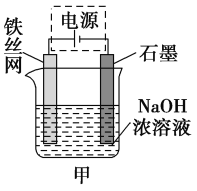
①电解过程中阳极的电极反应式为_______________________。
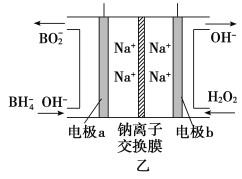
②图甲装置中的电源采用NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电源工作原理如图乙所示。工作过程中该电源的正极反应式为________________________,Na+由____________(填“a”或“b”,下同)极区移向____________极区。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com