
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)3C(g)+nD(g),开始时A为4mol,B为6mol,5 min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2molL﹣1min﹣1 .
计算:
(1)5min末A的物质的量浓度,
(2)B的转化率为.
(3)前5min内用B表示的化学反应速率v(B).
(4)化学方程式中n值.
【答案】
(1)解:在容积为2L的密闭容器中,开始时A为4mol,B为6mol,5min末时测得C的物质的量为3mol,则:
A(g) | + | 2B(g) | 3C(g) | + | nD(g) | ||
起始量(mol): | 4 | 6 | 0 | 0 | |||
变化量(mol): | 1 | 2 | 3 | n | |||
5min末(mol): | 3 | 4 | 3 | n |
5min末A的物质的量浓度为 ![]() =1.5mol/L,
=1.5mol/L,
答:5min末A的物质的量浓度为1.5mol/L
(2)解:B的转化率= ![]() ×100%=
×100%= ![]() =25%
=25%
答:B的转化率为25%
(3)解:前5min内用B表示的化学反应速率v(B)= ![]() =0.2mol/(Lmin),
=0.2mol/(Lmin),
答:前5min内用B表示的化学反应速率为0.2mol/(Lmin)
(4)解:速率之比等于化学计量数之比,则0.2mol/(Lmin):0.2mol/(Lmin)=2:n,故n=2,
答:n的值为2
【解析】在容积为2L的密闭容器中,开始时A为4mol,B为6mol,5min末时测得C的物质的量为3mol,则:
A(g) | + | 2B(g) | 3C(g) | + | nD(g) | ||
起始量(mol): | 4 | 6 | 0 | 0 | |||
变化量(mol): | 1 | 2 | 3 | n | |||
5min末(mol): | 3 | 4 | 3 | n |
(1.)根据c= ![]() 计算5min末A的物质的量浓度;
计算5min末A的物质的量浓度;
(2.)B的转化率= ![]() ;
;
(3.)根据v= ![]() 计算v(B);
计算v(B);
(4.)利用速率之比等于化学计量数之比计算n.


科目:高中化学 来源: 题型:
【题目】孔雀石主要成分是Cu2(OH)2CO3,还含少量FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
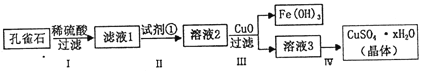
(1)步骤I中涉及的主要反应用离子方程式表示为___________.
(2)步骤Ⅱ中试剂①是_______(填代号).
a.KMnO4 b.H2O2 c.Fe粉 d.KSCN
(3)步骤Ⅲ加入CuO 的目的是_________
(4)步骤Ⅳ获得硫酸铜晶体,需要经过_____________冷却结晶、过滤等操作.
(5)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.41g硫酸铜晶体,在____(填实验仪器名称)中加热至质量不再改变时,称量粉末的质量为1.6g.则计算得x=______(计算结果精确到0.1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)= 9×10-4,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断中正确的是

A. a点对应的溶液中c(H+)·c(OH-) 的数值为1×10-14
B. a 点对应的Ksp不等于c点对应的Ksp
C. b 点将有沉淀生成,平衡后溶液中c(SO42-)= 3×10-3mol/L,而向d 点溶液中加入适量的CaSO4固体可以变到c 点
D. CaSO4的饱和溶液中c(SO42-) > c(Ca2+) >c(H+) >c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是①金属钠在纯氧中的燃烧产物,②在FeSO4溶液中滴入NaOH溶液并在空气中放置一段时间,③向FeCl3溶液中滴入KSCN溶液,④无水硫酸铜溶解于水.( )
A. ③②①④ B. ②③①④ C. ③①②④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述,正确的是( )
A. 石油的分馏和煤的气化都是发生了化学变化
B. 苯、溴水、铁粉混合可制成溴苯
C. 糖类、油脂、蛋白质在一定条件下均可以水解
D. 石油裂化的主要目的是提高轻质液体燃料的产量和质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣设计实验制取乙酸乙酯.现用右图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2ml98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题: 
(1)写出圆底烧瓶内发生反应的化学方程式为: .
(2)反应中加入浓硫酸的作用是 .
(3)球形干燥管C的作用是 .
(4)反应结束后D中的现象是:
(5)分离出D中的乙酸乙酯时需要的玻璃仪器是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1mol氢气完全燃烧生成水蒸气时放出热量242kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则氢气中1mol H﹣H键断裂时吸收热量为( )
A.920 kJ
B.557 kJ
C.436 kJ
D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中含有H+、Ba2+、Al3+、NH4+、Fe3+、Fe2+、CO32-、SO32-、Cl-、SO42-、NO3-中的几种(除此以外,无其他大量存在的离子),针对该溶液进行实验,内容如下:
①用洁净的玻璃棒蘸取少量X溶液,点在PH 试纸上,试纸呈红色;
②取适量X溶液,加入过量的Ba(NO3)2溶液,得澄清透明的溶液A,并放出一种无色无味的气体B,在瓶口又慢慢变为红棕色
③向溶液A 中加入过量的NaOH 溶液,微热,放出一种刺激性气味的气体C,同时产生红褐色沉淀D,过滤得溶液F;
④向F溶液中通入过量的CO2,有白色沉淀G生成。请回答:
(1)G的化学式为:___________________________。
(2)检验气体C的方法_____________________;
(3)步骤②中反应的离子方程式为:_________________________;
(4)步骤3③中反应的离子方程式为:_______________________________;
(5)X溶液中一定含有的离子是_______________________________;在不能确定是否含有的离子中,若要确定其中一种,补做的实验是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究PM 2.5、SO2、NOx等,对监测空气质量具有重要意义.取某样本用蒸馏水处理制成待测液,其中所含离子的化学组分及其浓度如下表:
离子 | K+ | Na+ | NH4+ | H+ | SO42﹣ | NO3﹣ | Cl﹣ |
浓度/molL﹣1 | 4×10﹣6 | 6×10﹣6 | 2×10﹣5 | a | 4×10﹣5 | 3×10﹣5 | 2×10﹣5 |
请回答下列问题:
(1)根据表中数据计算此待测液中c(H+)浓度a为 mol/L.
(2)NOx是汽车尾气中的主要污染物之一.
①汽车发动机工作时的高温会引发N2和O2反应,反应的化学方程式是 .
②NOx能形成酸雨,由NO2形成酸雨的主要反应是(写离子方程式).
(3)为减少SO2的排放,常采取的措施有:
①在燃煤中加入生石灰可以起到固硫的作用,SO2被吸收后转化成一种硫元素的最高价态的化合物,该物质的化学式是 .
②吸收烟气中的SO2 , 以下物质可作吸收剂的是(填序号);硫酸工业中的尾气SO2可以循环利用,写出SO2转化为SO3反应的化学方程式 .
a.NaOH b.H2SO4 c.NaHSO3 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com