
| A. | Zn | B. | Mg | C. | Al | D. | Fe |
分析 因金属与酸的反应属于氧化还原反应,则利用氧化还原反应中得失电子守恒可快速解答.
解答 解:设金属在化合物中的化合价为x,金属的摩尔质量为M,酸足量时生成的标准状况下的氢气体积为2.24L,则其物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,由电子守恒可知,$\frac{1.8g}{M}$×(x-0)=0.1mol×2×(1-0),即9x=M,
A、锌的摩尔质量为65g/mol,在化合物中的化合价为+2价,不符合9x=M,故A错误;
B、镁的摩尔质量为24g/mol,在化合物中的化合价为+2价,不符合9x=M,故B错误;
C、铝的摩尔质量为27g/mol,在化合物中的化合价为+3价,符合9x=M,故C正确;
D、铁的摩尔质量为56g/mol,与盐酸反应后生成的化合物中的化合价为+2价,不符合9x=M,故D错误;
故选C.
点评 本题的解答方法有多种,利用氧化还原反应中得失电子守恒来计算是较好的方法,也可利用信息写出化学反应方程式来计算,学生应学会灵活处理.


科目:高中化学 来源: 题型:解答题
 用50mL0.50mol/L盐酸与50mL0.55mol/L氢氧化钠溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/L氢氧化钠溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙两试管都有白色沉淀生成 | B. | 甲、乙两管都没有白色沉淀生成 | ||
| C. | 甲管没有白色沉淀生成而乙试管有 | D. | 甲管有白色沉淀而乙试管没有 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
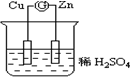 如图所示的原电池装置中,锌为负极,电极发生的是氧化反应(填氧化或还原),电极反应式为Zn-2e-=Zn2+;铜电极反应式为2H++2e-=H2↑,铜片上观察到的现象为有气泡产生.
如图所示的原电池装置中,锌为负极,电极发生的是氧化反应(填氧化或还原),电极反应式为Zn-2e-=Zn2+;铜电极反应式为2H++2e-=H2↑,铜片上观察到的现象为有气泡产生.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L任意比的O2和N2的混合气体中含有的分子总数均为NA | |
| B. | 标准状况下,14 g氮气含有的氮原子数为0.5NA | |
| C. | 标准状况下,5.6 L四氯化碳含有的分子数为0.25NA | |
| D. | 标准状况下,22.4LH2O所含有的电子数是10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏 | B. | 煤的干馏 | ||
| C. | 氧气变臭氧 | D. | 乙烯通入溴水,溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该晶体为原子晶体 | B. | 该物质的熔沸点较低 | ||
| C. | 该物质是新化合物 | D. | 该物质的相对分子量质量为2400 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 变成
变成 .现有某烯烃A,分子式为C4H8,被酸性高锰酸钾溶液氧化后不可能得到的产物是( )
.现有某烯烃A,分子式为C4H8,被酸性高锰酸钾溶液氧化后不可能得到的产物是( )| A. | CH3COOH | B. | CO2和 | ||
| C. | CO2和CH3CH2COOH | D. | HCOOH和CH3CH2COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com