
һ���¶��£��ڼס��ҡ��������ĸ������ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ�������ж��в���ȷ����
| �� | �� | �� | �� | |
�ܱ��������/L | 2 | 2 | 2 | 2 | |
��ʼ���ʵ��� | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2��ƽ��ת����% | 80 |
|
|
| |
A�����з�Ӧ��ƽ�ⳣ��С����B�����¶��£��÷�Ӧ��ƽ�ⳣ��KΪ400
C��SO2��ƽ��ת���ʣ�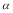 1<
1<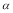 2 =
2 = 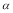 3 D��������SO3�����ʵ���Ũ�ȣ���=��<��
3 D��������SO3�����ʵ���Ũ�ȣ���=��<��
AD
��������
���������2SO2(g)��O2(g)  2SO3(g)���÷�Ӧ������Ӧ�����������С�ķ��ȷ�Ӧ��A�����ڼס��ҷ�Ӧ������ͬ���¶��½��еģ����Է�Ӧ��ƽ�ⳣ����ͬ������B.���ڼף�����SO2��ƽ��ת����%��0.80��������ƽ��ʱ�������ʵ�Ũ�ȷֱ��ǣ�c(SO2):0.04mol/L��c(O2):0.04mol/L��c(SO3):0.16mol/L������ƽ�ⳣ��K=
2SO3(g)���÷�Ӧ������Ӧ�����������С�ķ��ȷ�Ӧ��A�����ڼס��ҷ�Ӧ������ͬ���¶��½��еģ����Է�Ӧ��ƽ�ⳣ����ͬ������B.���ڼף�����SO2��ƽ��ת����%��0.80��������ƽ��ʱ�������ʵ�Ũ�ȷֱ��ǣ�c(SO2):0.04mol/L��c(O2):0.04mol/L��c(SO3):0.16mol/L������ƽ�ⳣ��K=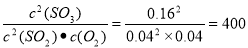 ����ȷ��C����������ױȽϣ�SO2��Ũ������������Ũ�Ȳ��䣬��������������ʱ������Ӧ���Ũ����ƽ�������ƶ���������Ӧ���ת������ߣ����䱾����ת���ʽ��ͣ�����SO2��ƽ��ת���ʣ�
����ȷ��C����������ױȽϣ�SO2��Ũ������������Ũ�Ȳ��䣬��������������ʱ������Ӧ���Ũ����ƽ�������ƶ���������Ӧ���ת������ߣ����䱾����ת���ʽ��ͣ�����SO2��ƽ��ת���ʣ�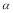 1<0.80�������ұȽϣ�������Ũ�����������������䣬��SO2��ƽ��ת���ʣ�
1<0.80�������ұȽϣ�������Ũ�����������������䣬��SO2��ƽ��ת���ʣ�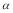 2>0.80;
2>0.80;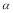 1<
1<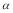 2 ��������Ƚϣ����ʵ����ı���ͬ�������ǵ�Чƽ��SO2��ƽ��ת���ʣ�
2 ��������Ƚϣ����ʵ����ı���ͬ�������ǵ�Чƽ��SO2��ƽ��ת���ʣ�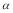 3=
3=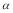 2������ת���ʹ�ϵ�ǣ�
2������ת���ʹ�ϵ�ǣ�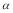 2=
2=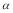 3>
3>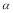 1,��ȷ��D�������������и������ʵ����ʵ����Ķ��Ķ����������������䣬���Դﵽƽ����������SO3�����ʵ���Ũ�ȣ���>��,����
1,��ȷ��D�������������и������ʵ����ʵ����Ķ��Ķ����������������䣬���Դﵽƽ����������SO3�����ʵ���Ũ�ȣ���>��,����
���㣺�����Чƽ�⡢���ʵ�ƽ��ת���ʡ����ʵ���Ũ�ȶԻ�ѧƽ���ƶ���Ӱ���֪ʶ��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�ϲ�����У�����ϵ�һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ�����������˵����ȷ����
A��0.1 mol Fe���������ᷴӦ��ת�Ƶĵ�����Ϊ0.3 NA
B��28 g CO��������ԭ����Ϊ2 NA
C��0.1 mol��L-1 Na2CO3��Һ�У����� ��Ϊ0.1 NA
��Ϊ0.1 NA
D����״���£�22.4 L���ķ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ������ѧ�ڵ�һѧ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A�������ᡢ��ʯ�ҡ���������ʯ�ҷֱ������ᡢ��Ρ�������
B���������ˮ��Һ������״̬�¾�һ���ܵ���
C����⡢��Ӿ�������Ҫͨ��ſɽ��У������롢ԭ��ص��µĸ�ʴ����Ҫͨ��
D����������ˮ�Ĺ����У�һ���з��Ȼ�������������ܽ�IJ�����������Ͳ�н���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭����У������һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ�������ֵ������������ȷ���� �� ��
 A��25��ʱ��1.0L pH=13��Ba(OH)2��Һ�к��е�OH����ĿΪ0.2NA
A��25��ʱ��1.0L pH=13��Ba(OH)2��Һ�к��е�OH����ĿΪ0.2NA
 B����״���£�2.24L Cl2�����ϡNaOH��Һ��Ӧ��ת�Ƶĵ�������Ϊ0.2NA
B����״���£�2.24L Cl2�����ϡNaOH��Һ��Ӧ��ת�Ƶĵ�������Ϊ0.2NA
 C�������£�21.0g��ϩ�Ͷ�ϩ�Ļ�������к��е�̼ԭ����ĿΪ1.5NA
C�������£�21.0g��ϩ�Ͷ�ϩ�Ļ�������к��е�̼ԭ����ĿΪ1.5NA
 D����״���£�22.4L �״��к��е���ԭ����Ϊ1.0NA
D����״���£�22.4L �״��к��е���ԭ����Ϊ1.0NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�����и���9��ѧ����л�ѧ�Ծ��������棩 ���ͣ������
��14�֣������ѣ�CH3OCH3����һ����ࡢ��Ч�����������Ļ������ܵĿ�ȼ�����Ϊ21���͵�������Դ����ҵ�Ʊ������ѵ������������£�
����Ӧ���У�ѹ��2.0~10.0MPa���¶�300�棩�������з�Ӧ��
��CO(g)+2H2(g) CH3OH(g)��H 1= - 90.7 kJ��mol��1
CH3OH(g)��H 1= - 90.7 kJ��mol��1
��2CH3OH(g)  CH3OCH3(g)+H2O(g)��H2 = - 23.5 kJ��mol��1
CH3OCH3(g)+H2O(g)��H2 = - 23.5 kJ��mol��1
��CO(g)+H2O(g)  CO2(g)+H2(g) ��H3 = - 41.2 kJ��mol��1
CO2(g)+H2(g) ��H3 = - 41.2 kJ��mol��1
��1������Ӧ���е��ܷ�Ӧ��3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)��
CH3OCH3(g)+CO2(g)��
�÷�Ӧ�ķ�Ӧ�ȡ�H =_________������Ӧ���в���300��ķ�Ӧ�¶ȣ������ǡ�
��2����֪����Ӧ����300��ʱ�Ļ�ѧƽ�ⳣ��Ϊ0.27�����¶��½�2 mol CO��3 mol H2��2 mol CH3OH�����ݻ�Ϊ2 L���ܱ������У���ʱ��Ӧ�� ���������С�����������С�����ƽ��״̬������
��3�����������ж����Ѿ��Ƶ�ʵ���������Ϊ��
��4����ͼΪ��ɫ��Դ��������ȼ�ϵ�ء��Ĺ���ԭ��ʾ��ͼ��

�õ�ع���ʱ��H+���ƶ����������������a�缫�ĵ缫��ӦʽΪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�����и���9��ѧ����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��б���������ת��Ϊ��������������仯��ͼ��ʾ������˵����ȷ���ǣ���
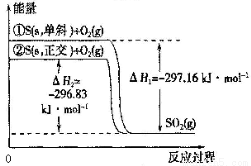
A��S(s����б) = S(s������)��H = + 0.33 kJ��mol��1
B����ͬ���ʵ�����������ȵ�б�������е�������
C��������ȵ�б���ȶ�
D���ٱ�ʾ����1mol O2�еĹ��ۼ������յ��������γ�l mol SO2�еĹ��ۼ����ų���������297.16 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�����и���9��ѧ����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
25��ʱ�����и���������ָ����Һ��һ���ܴ����������
A��0.1mol��L��1 AlC13��Һ�У�H+��Na+��Cl����SO42��
B������0.1mol��L��1 Fe3+����Һ�У�Na+��K+��SCN����NO3��
C��ʹ���ȱ��ɫ����Һ�У�Fe2+��K+��NO3����SO42��
D����ˮ���������c(H+)=10��12 mol��L��1����Һ�У�NH4+��SO42����HCO3����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ������Э����߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������и�װ��ͼ�������У�����ȷ����
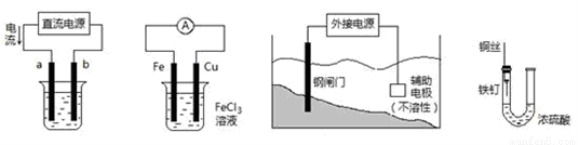
�� �� �� ��
A����װ�âپ���ͭ����a��Ϊ��ͭ���������ҺΪCuSO4��Һ
B��װ�âڵ��ܷ�Ӧ�ǣ�Cu+2Fe3+��Cu2++2Fe2+
C��װ�â��и�բ��Ӧ����ӵ�Դ�ĸ�������
D��װ�â��е���������û����ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ���������и߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
����������Դ������̼���ŷţ�ʵʩ��̼�����ǽ��������������
�����д�ʩ��������Ч���ٶ�����̼�ŷŵ��� ��
A��ֲ�����֣�����ɭ�֣�����ֲ��
B���Ӵ��ú��ʯ�͵Ŀ��ɣ�������ʹ��ʯ��Һ����
C���ƹ�ʹ�ý��ܵƺͽ��ܵ�����ʹ�ÿյ�ʱ�ļ��¶Ȳ������ù��ͣ����첻�˹���
D����������ʱ�ಽ�к������г��������ִ�������Ϣϵͳ���������乤�߿�ʻ��
�ƿ�ѧ�������ڶ�����̼�ġ����ת���������о����罫CO2��H2��1��4�������ͨ�뷴Ӧ�����ʵ������·�Ӧ�ɻ��һ����Դ��������»�ѧ����ʽ��CO2��4H2 ��2H2O��
��2H2O��
��CO2�ϳ�����ȼ�ϼ״���CH3OH����̼���ŵ��·���������ʵ�飺ij�¶�����1 L���ܱ������У���2 mol CO2��6 mol H2��������CO2(g)+3H2(g ) CH3OH(g)+H2O(g)���жϸ÷�Ӧ�Ѵﻯѧ��Ӧ�ȱ�־���� ������ĸ����
CH3OH(g)+H2O(g)���жϸ÷�Ӧ�Ѵﻯѧ��Ӧ�ȱ�־���� ������ĸ����
A��CO2�ٷֺ������ֲ���
B��������H2Ũ����CO2Ũ��֮��Ϊ3:1
C�������л��������������ֲ���
D��CO2����������CH3OH�����������
�ֲ��CO2��CH3OH��g����Ũ����ʱ��仯������ͼ��ʾ���ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v��H2��= mol/��L��min����


��CO�ڴ�������Ҳ�����ɼ״���CO(g)+2H2(g)  CH3OH(g)����֪�ܱ������г���10 mol CO��20 mol H2��CO��ƽ��ת���ʣ��������¶ȡ�ѹǿ�Ĺ�ϵ������ͼ��ʾ��
CH3OH(g)����֪�ܱ������г���10 mol CO��20 mol H2��CO��ƽ��ת���ʣ��������¶ȡ�ѹǿ�Ĺ�ϵ������ͼ��ʾ��
����A��C���㶼��ʾ�ﵽ��ƽ��״̬�����Է�Ӧ��ʼ����ƽ��״̬�����ʱ��tA tC������ڡ�����С�ڡ����ڡ�����
����A��B�����ʾ��ijʱ�̴ﵽ��ƽ��״̬����ʱ��A��ʱ���������ΪVAL����A��B����ʱ�����У�n(A)�ܩUn(B)��= ��
����KOHΪ����ʵļ״�ȼ�ϵ���ܷ�ӦΪ��2CH3OH+3O2+4KOH = 2K2CO3+6H2O��ͨ��״��ĵ缫Ϊȼ�ϵ�صĸ��������������ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com