
����Ŀ���о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��1����֪��2SO2(g��+O2(g��![]() 2SO3(g�� ��H= -196.6kJ��mol-1
2SO3(g�� ��H= -196.6kJ��mol-1
2NO(g��+O2(g��![]() 2NO2(g�� ��H= -113.0kJ��mol-1
2NO2(g�� ��H= -113.0kJ��mol-1
��ӦNO2(g��+SO2(g��![]() SO3(g��+NO(g������H= kJ��mol-1
SO3(g��+NO(g������H= kJ��mol-1
��2��һ�������½�NO2��SO2�������2��1�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬����
A����ϵѹǿ���ֲ���
B�����������ɫ���ֲ���
C��SO3��NO������ȱ��ֲ���
D��ÿ����1molSO3��ͬʱ����1mol NO
���������Ӧ��ƽ��ʱNO2��SO2�������Ϊ5��1����NO2��ת���� =
��3��CO�����ںϳɼ״�����Ӧ����ʽΪCO(g��+2H2(g��![]() CH3OH(g����CO�ڲ�ͬ�¶��µ�ƽ��
CH3OH(g����CO�ڲ�ͬ�¶��µ�ƽ��
ת������ѹǿ�Ĺ�ϵ��ͼ��2����ʾ���÷�Ӧ��H 0(��������������������ʵ����������������250����1.3��104kPa���ң�ѡ���ѹǿ�������ǣ� ��
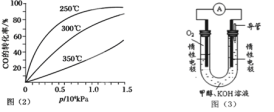
��4������ȼ�յķ�Ӧԭ�����ϳɵļ״����������ͼ��3����ʾ��ԭ���װ�á�
�� �õ�ع���ʱ��OH- �� ���ƶ�(��������������������
�� �õ�������ĵ缫��ӦʽΪ ��
���𰸡���1��-41.8����2��BD��0.375����3��������1.3��104kPa�£�CO��ת�����ѽϸߣ�������ѹǿCO��ת������߲��������ɱ����ӵò���ʧ����4������O2+2H2O+4e-�TOH-��
��������
�����������1��2SO2(g��+O2(g��![]() 2SO3(g������2NO(g��+O2(g��
2SO3(g������2NO(g��+O2(g��![]() 2NO2(g������(��������/2��NO2(g����SO2(g��
2NO2(g������(��������/2�ó���NO2(g����SO2(g�� ![]() SO3(g����NO(g�� ��H=(��196.6��113��/2kJ��mol��1=��41.8kJ��mol��1����2��A����Ӧ����ʽ������ϵ��֮����ȣ�ѹǿ������Ϊ�ﵽƽ��ı�־���ʴ���B��NO2����ɫ���壬����Ϊ��ɫ����������ɫ���䣬˵���ﵽƽ�⣬����ȷ��C��������Ϊ�ﵽƽ��ı�־���ʴ���D���ò�ͬ�����ʱ�ʾ�ﵽƽ�⣬Ҫ��Ӧ����һ��һ�棬�ҷ�Ӧ����֮�ȵ���ϵ��֮�ȣ�����ȷ��
SO3(g����NO(g�� ��H=(��196.6��113��/2kJ��mol��1=��41.8kJ��mol��1����2��A����Ӧ����ʽ������ϵ��֮����ȣ�ѹǿ������Ϊ�ﵽƽ��ı�־���ʴ���B��NO2����ɫ���壬����Ϊ��ɫ����������ɫ���䣬˵���ﵽƽ�⣬����ȷ��C��������Ϊ�ﵽƽ��ı�־���ʴ���D���ò�ͬ�����ʱ�ʾ�ﵽƽ�⣬Ҫ��Ӧ����һ��һ�棬�ҷ�Ӧ����֮�ȵ���ϵ��֮�ȣ�����ȷ��
NO2(g����SO2(g�� ![]() SO3(g����NO(g��
SO3(g����NO(g��
��ʼ�� 2 1 0 0
�仯�� x x x x
ƽ�⣺ 2��x 1��x x x �������⣺(2��x����(1��x��=5��1�����x=0.75����ת����Ϊ0.75/2��100%=37.5%����3�������¶����ߣ�CO��ת���ʽ��ͣ�������������ԭ����������Ӧ����Ϊ���ȷ�Ӧ����H��0����1.3��104kPa�£�CO��ת�����ѽϸߣ�������ѹǿCO��ת������߲��������ɱ����ӵò���ʧ����4����ͨ������һ��Ϊ�������״�һ��Ϊ����������ԭ��صĹ���ԭ��Ϊ�����������ƶ����� O2+2H2O+4e-�TOH-��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���� ��
A�� SiH4�ķе����CH4�����Ʋ�PH3�ķе����NH3
B��NH4+Ϊ��������ṹ�����Ʋ��PH4+ ҲΪ��������ṹ
C��Si������ԭ�Ӿ��壬���Ʋ���C���γɵľ���Ҳ��ԭ�Ӿ���
D��NaCl�����ӻ�������Ʋ�AlCl3Ҳ�����ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��������̼ԭ����ɵ������η䳲״ƽ�污Ĥ�������ɣ����������쳣����ѧ����ѧ�ͻ�ѧ���ܡ����й���̼���ܵ�˵������ȷ����
A��̼��������һ���л��ϳ���ά
B��̼��������ʯ��Ϊͬ��������
C�������£�̼���ܾ��нϺõ��ȶ���
D��̼���ܱȱ�������������ʹ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3��g��+5O2��g��![]() 4NO��g��+6H2O��g�� ��H��0������������ȷ����
4NO��g��+6H2O��g�� ��H��0������������ȷ����
A���ﵽ��ѧƽ��ʱ4v����O2��=5v����NO��
B������λʱ��������x mol NO��ͬʱ������x mol NH3����Ӧ��ƽ��״̬
C���ﵽ��ѧƽ��ʱ�����������������������Ӧ���ʼ�С���淴Ӧ��������
D���ﵽ��ѧƽ��ʱ���������¶ȣ�������Ӧ���ʼ�С���淴Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ʵ����ʵ���������У���ȷ���ǣ� ��
ʵ����ʵ | ���� | |
A | A��B�����л��������ͬ����Է��������Ͳ�ͬ�Ľṹ | A��B��Ϊͬ���칹�� |
B | ������ͬ��A��B�����л�����ȫȼ������������ͬ��ˮ | A��B���л������ʽ��ͬ |
C | A��B�����л���ṹ���ƾ�����ͬ��ͨʽ | A��B��Ϊͬϵ�� |
D | ����ʽΪC6H6����A����ʹ���CCl4��Һ��ɫ������ʹ����KMnO4��Һ��ɫ | A�Ľṹ��ʽ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����·�Ӧ�������ɫ��ѧԭ�Ӿ���Ҫ����ǣ� ��
A. ��ϩ�ۺ�Ϊ����ϩ�߷��Ӳ���
B. �����������Ʊ�һ�ȼ���
C. ������ŨHNO3Ϊԭ������������
D. ��̼����ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п��һ�ֳ��ý������أ�Ga���Ļ����ﵪ���أ�GaN��������LED����Ҫ���ϣ�����Ϊ�������뵼����ϡ�
I���أ�Ga���ǻ�ұ��п�����еĸ���Ʒ��������ͬ���������ڣ���ѧ�����������ơ�
��Ga��ԭ�ӽṹʾ��ͼΪ ___________________��
��GaN����Ga��NH3�ڸ�����������ȡ���÷�Ӧ�Ļ�ѧ����ʽ ��
�������й��غ��صĻ������˵����ȷ����____ ��
A�������£�Ga����ˮ���ҷ�Ӧ�ų�����
B��һ�������£�Ga�������������������
C��һ�������£�Ga2O3����NaOH��Ӧ������
D��Ga2O3����Ga(OH)3���ȷֽ�õ�
II��п��ұ�������л�ʪ������ҵ������п��ɰ����Ҫ��ZnO��ZnFe2O4������������CaO��FeO��CuO��NiO�������ʪ����ȡ����п��������ͼ��ʾ��
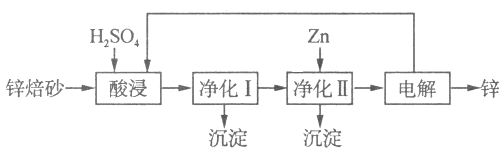
��֪��Fe�Ļ�����ǿ��Ni
��ZnFe2O4����д��ZnO��Fe2O3��ZnFe2O4��H2SO4��Ӧ�Ļ�ѧ����ʽΪ ��
������I������Ϊ��������һ���ǽ���Һ��������Fe2+�������ڶ����ǿ�����ҺpH��ֻʹFe3+ת��ΪFe(OH)3����������I���ɵij����л�������Һ�е��������ʣ���Һ�е��������ʱ���ͬ������ԭ����____________________��
������II�м���Zn��Ŀ����___________________��
�������£�����I�У����Ҫʹc(Fe3+) < 10-5 mol/L����Ӧ������ҺpH�ķ�ΧΪ_____________����֪��Ksp[Fe(OH)3] = 8.0 �� 10-38��lg5 = 0.7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¹�������ҵ��־��Ӧ�û�ѧ���Ͽ������½��ܣ�ij�е������о�С�����������һ�֡�ˮƿ�����ø���ϩ(C60)��������������ƿ�塱��һ������������ƿ�ǡ���ǡ�ÿɽ�һ��ˮ���ӹ������档����˵����ȷ����( )
A��ˮ��˫��ˮ��ˮ�������Ǵ�����
B��ʯī��C60����Ϊͬλ��
C��������ǿ�����ǿ�����
D��һ��������ʯīת��ΪC60�ǻ�ѧ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ���ش��������⣺
��1����ϩ�ĵ���ʽΪ ���ṹ��ʽΪ ��
��2�����п��Լ���������ϩ���Լ�Ϊ ����ѡ����ĸ����
A��ϡ���� B��������Ȼ�̼��Һ C��ˮ D�����Ը��������Һ
��3�����������У�����ͨ����ϩ�ӳɷ�Ӧ�õ����� ����ѡ����ĸ����
A��CH3CH3 B��CH3CHCl2 C��CH3CH2OH D��CH3CH2Br
��4����֪2CH3CHO��O2![]() 2CH3COOH������ϩΪ��Ҫԭ�Ϻϳ��������ϳ���·����ͼ��ʾ��
2CH3COOH������ϩΪ��Ҫԭ�Ϻϳ��������ϳ���·����ͼ��ʾ��
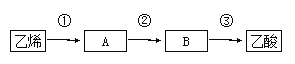
��Ӧ�۵ķ�Ӧ����Ϊ ��Ӧ����Ӧ�ڵĻ�ѧ����ʽΪ ��
��5����ҵ������ϩΪԭ�Ͽ�������һ����Ҫ�ĺϳ��л��߷��ӻ�����÷�Ӧ����Ϊ ��Ӧ���䷴Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com