
现要测定某氯化亚铁和氯化铁混合物中铁元素的质量分数,按以下步骤进行实验:
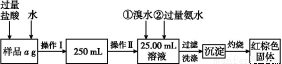
Ⅰ.请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式: 。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3 g,则接下来还应进行的操作是 。
若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 。
Ⅱ.有同学提出,还可以采用以下方法来测定:
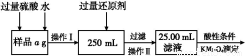
(1)溶解样品改用了硫酸,而不再用盐酸,为什么? 。
(2)选择的还原剂是否能用铁 (填“是”或“否”),原因是: 。
(3)若滴定用掉c mol/L KMnO4溶液b mL,则样品中铁元素的质量分数是 。
Ⅰ.(1)250 mL容量瓶(2分) 胶头滴管(2分)
(2)2Fe2++Br2 2Fe3++2Br-(2分)
2Fe3++2Br-(2分)
(3)再次加热并冷却至室温称量,直至两次质量差小于0.1 g(2分) 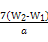 ×100%(1分)
×100%(1分)
Ⅱ.(1)过量的盐酸对后面KMnO4的滴定有干扰(2分)
(2)否(1分) 如果用铁作还原剂,自身的氧化产物是Fe2+,且会与过量的硫酸反应生成Fe2+,干扰铁元素的测定(2分)
(3)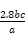 ×100%(1分)
×100%(1分)
【解析】Ⅰ.(1)根据流程图,操作Ⅰ是配制一定物质的量浓度的溶液,因此另外的玻璃仪器为250 mL容量瓶和胶头滴管。(2)加入溴水将Fe2+氧化。(3)b1-b2=0.3 g,说明误差大,因此需再次加热并冷却至室温称量,直至两次质量差小于0.1 g,氧化铁的质量为(W2-W1)g,则原样品中铁元素的质量为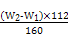 ×
×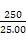 g=7(W2-W1) g,其质量分数为
g=7(W2-W1) g,其质量分数为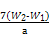 ×100%。
×100%。
Ⅱ.该方法的原理是用还原剂将Fe3+还原为Fe2+,然后用KMnO4溶液滴定,若用盐酸,则过量的盐酸被KMnO4氧化,使铁元素的质量分数偏大;不能用铁作还原剂,否则使铁元素的质量分数偏大。5F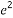 ~Mn
~Mn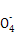 ,则原样品中n(Fe)=n(Fe2+)=5×bc×10-3×
,则原样品中n(Fe)=n(Fe2+)=5×bc×10-3×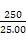 mol=0.05bc mol,则m(Fe)=0.05bc×56 g=2.8bc g,其质量分数为
mol=0.05bc mol,则m(Fe)=0.05bc×56 g=2.8bc g,其质量分数为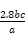 ×100%。
×100%。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源:2014高考化学苏教版总复习 专题12物质结构与性质练习卷(解析版) 题型:选择题
下列各组原子中,彼此的化学性质一定相似的是( )
A.P原子:1s2;Q原子:2s2
B.P原子:M能层上有2个电子;Q原子:N能层上有2个电子
C.P原子:2p能级上有1个未成对电子;Q原子:3p能级上也有1个未成对电子
D.P原子:最外层L能层上只有一个空轨道;Q原子:最外层M能层上也只有一个空轨道
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题10化学实验基础练习卷(解析版) 题型:选择题
下列有关实验的描述正确的是( )
A.氢氧化钠固体保存在配有橡皮塞的细口瓶中
B.将SO2通入品红溶液或KMnO4溶液均能使它们褪色,均可证明SO2有漂白性
C.不能在石英坩埚中熔化氢氧化钠
D.用湿润的pH试纸测定稀盐酸的pH
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师高考模拟演练练习卷(B)(解析版) 题型:填空题
某探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
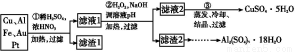
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为 。
(2)第②步加H2O2的作用是 ;
调溶液pH的目的是使 生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是 。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
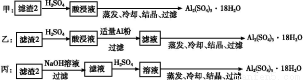
上述三种方案中, 方案不可行,原因是 ;
从原子利用率角度考虑, 方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++H2Y2- CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是 。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师高考模拟演练练习卷(B)(解析版) 题型:选择题
化学与环境、生活、科研息息相关,下列说法错误的是( )
A.双氧水稀溶液可用于清洗伤口
B.14C可用于文物的年代鉴定,14C和12C互为同位素
C.PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶
D.自来水厂可使用Cl2和FeSO4·7H2O进行消毒、净化,以改善水质
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师高考模拟演练练习卷(A)(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述中一定正确的是( )
A.一定条件下4.6 g Na完全与O2反应生成7.2 g产物,失去的电子数为0.2NA
B.50 mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2的分子数为0.46NA
C.一定条件下某密闭容器盛有0.1 mol N2和0.3 mol H2,充分反应后转移电子数为0.6NA
D.电解1 L NaCl溶液至c(OH-)=0.2 mol/L,转移电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 离子反应练习卷(解析版) 题型:选择题
下表对某些反应方程式的评价合理的是( )
编号实验离子方程式或电极反应式评价
A次氯酸钙溶液中通入足量SO2Ca2++ClO-+SO2+H2O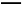 CaSO4↓+Cl-+2H+ 正确
CaSO4↓+Cl-+2H+ 正确
BBa(OH)2溶液中加入过量Al2(SO4)3溶液3Ba2++6OH-+2Al3++3S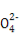
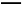 3BaSO4↓+2Al(OH)3↓ 正确
3BaSO4↓+2Al(OH)3↓ 正确
C醋酸铵溶于水CH3COO-+N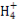
 CH3COOH+NH3·H2O错误,阴阳离子水解相互促进,应该用“
CH3COOH+NH3·H2O错误,阴阳离子水解相互促进,应该用“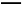 ”号
”号
D用惰性电极电解氯化铜和氯化钠的混合溶液一段时间阴极:Cu2++2e-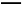 Cu
Cu
阳极:4OH--4e-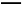 2H2O+O2↑错误,只因为两极得失电子没配平
2H2O+O2↑错误,只因为两极得失电子没配平
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 电解质溶液练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.100 ℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
B.室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均
减小
C.向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
D.向CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 化学与STSE练习卷(解析版) 题型:选择题
化学与生产、生活、社会密切相关。下列有关说法错误的是( )
A.大气中直径小于或等于2.5微米的颗粒物(PM2.5)会造成空气污染,应加强监测和治理
B.明矾和氯气均可用于水的消毒、杀菌
C.硬铝属于合金材料,餐桌上的瓷盘属于硅酸盐制品
D.不需要通过化学反应就能从海水中获得食盐和淡水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com