
| 滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0 (另加少量可溶于水MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
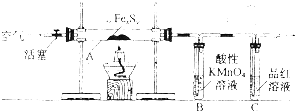
 =25.00mL.根据关系式2MnO4-~5H2C2O4计算25溶液中n未反应(MnO4-)=
=25.00mL.根据关系式2MnO4-~5H2C2O4计算25溶液中n未反应(MnO4-)= ×0.01mol?L-1×25×10-3L=1×10-4mol,50mL溶液中未反应的高锰酸钾的物质的量为1×10-4mol×
×0.01mol?L-1×25×10-3L=1×10-4mol,50mL溶液中未反应的高锰酸钾的物质的量为1×10-4mol×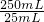 =1×10-3mol,装置B中n反应(MnO4-)=n总(MnO4-)-n未反应(MnO4-)=50×10-3L×0.1mol?L-1-1×10-3mol=4×10-3mol,根据关系式2MnO4-~5SO2计算生成二氧化硫n(SO2)=2.5×4×10-3mol=0.01mol,0.6g固体是Fe2O3,n(Fe)=
=1×10-3mol,装置B中n反应(MnO4-)=n总(MnO4-)-n未反应(MnO4-)=50×10-3L×0.1mol?L-1-1×10-3mol=4×10-3mol,根据关系式2MnO4-~5SO2计算生成二氧化硫n(SO2)=2.5×4×10-3mol=0.01mol,0.6g固体是Fe2O3,n(Fe)= ×2=0.0075mol,所以n(Fe):n(SO2)=0.0075mol:0.01mol=3:4,该铁硫簇结构的化学式为Fe3S4,
×2=0.0075mol,所以n(Fe):n(SO2)=0.0075mol:0.01mol=3:4,该铁硫簇结构的化学式为Fe3S4,

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com