
| A. | 乙烯的结构简式:CH2CH2 | B. | 甲烷的比例模型: | ||
| C. | 硫化钾的电子式: | D. | CO2的结构式:O-C-O |
分析 A、结构简式中必须标出有机物的官能团,乙烯分子中含有碳碳双键;
B、甲烷为正四面体结构,碳原子比较大于氢原子,此为其球棍模型;
C、硫化钾为离子化合物;
D、二氧化碳为直线型结构,分子中存在两个碳氧双键.
解答 解:A、乙烯分子中含有碳碳双键,其结构简式中应该标出官能团,乙烯正确的结构简式为CH2=CH2,故A错误;
B、比例模型能够体现出分子中各原子的相对体积大小,甲烷分子中碳原子半径大于氢原子,甲烷的比例模型为 ,故B错误;
,故B错误;
C、硫化钾为离子化合物,其电子式为 ,故C正确;
,故C正确;
D、二氧化碳为直线型结构,二氧化碳的结构式为O=C=O,故D错误,
故选C.
点评 本题主要考查的是常见化学用语的表示方法,熟练含有官能团的物质结构简式中必须标明官能团,注意区分球棍模型与比例模型,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ⑤⑥ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 5 | C. | 6 | D. | 10000 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CBr2F2 | B. | CH3CH2OH | C. | CH3CH2CH3 | D. | CH3CH(OH)COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
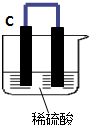 如图所示,将锌、铜通过导线相连置于稀硫酸中.
如图所示,将锌、铜通过导线相连置于稀硫酸中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ③④ | C. | ②④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com