
| A.三种元素的简单阴离子的还原性按X、Y、Z的顺序增强 |
| B.单质的氧化性按X、Y、Z的顺序减弱 |
| C.原子半径按X、Y、Z的顺序减小 |
| D.气态氢化物的稳定性按X、Y、Z的顺序减弱 |
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源:不详 题型:填空题
 价氧化物对应水化物酸性最强的酸是________________;
价氧化物对应水化物酸性最强的酸是________________; ____________。
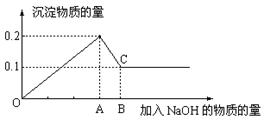
____________。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
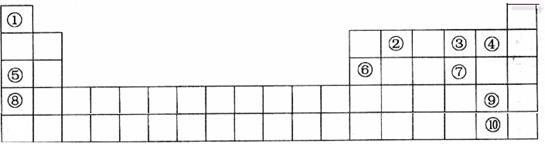
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③④⑨ | B.③④⑤⑦⑧⑨ | C.②③④⑧⑨ | D.①③⑤⑧ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
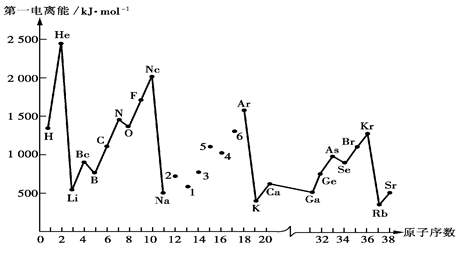
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | |
 当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是____________________(填离子键或共价键)。
当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是____________________(填离子键或共价键)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②⑤⑥⑧ | B.①③④⑤ | C.②④⑤⑦ | D.③⑤⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com