
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、—3 | —2 |
下列叙述正确的是
A.X、Y元素的最高价氧化物对应的水化物的碱性 :Y比X弱
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于浓氨水
D.一定条件下,X单质可以将W单质从其氢化物中置换出来
科目:高中化学 来源: 题型:
下列除去杂质(括号内为杂质)的方法正确的是
①乙烷(乙烯) 光照条件下通入Cl2,气液分离 ②乙酸乙酯(乙酸) 用饱和碳酸钠溶液洗涤、分液 ③苯(苯酚) 用氢氧化钠溶液洗涤、分液 ④乙醇(水) 加足量生石灰、蒸馏
A.①②③ B.①②④ C.①③④ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
鲨鱼是世界上唯一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性.已知角鲨烯分子中含有30个碳原子及6个C=C且不含环状结构,则其分子式为
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料。下列实验事实与硝酸性质不相对应的一组是 ( )
A.浓硝酸使紫色石蕊试液先变红后褪色——酸性和强氧化性
B.不能用稀硝酸与锌反应制氢气——强氧化性
C.要用棕色瓶盛装浓硝酸——不稳定性
D.稀硝酸能使滴有酚酞的氢氧化钠溶液红色褪去——强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,回答有关问题:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ⑴ | ⑵ | ||||||
| 三 | ⑶ | ⑷ | ⑸ | ⑹ | ⑺ | ⑻ | ⑼ | |
| 四 | ⑽ | ⑾ | ⑿ |
(1)写出下列元素符号:⑴ ,⑹
(2)在这些元素中,最不活泼的元素的结构示意图是 。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的与呈两性的发生反应的化学方程式为 ;碱性最强的与呈两性的发生反应的离子方程式为 .
(4)在⑵⑶⑻⑽这些元素简单离子中,离子半径由大到小的顺序是 (填离子符号)
(5)元素⑻、⑾和氧元素形成一种广泛使用杀菌消毒剂,该物质中存在的化学键有 。(2分)
(6)用电子式表示由元素(8)和(10)形成化合物的过程: 。(2分)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列操作会促进H2O的电离,且使溶液pH>7的是 ( )
A.将纯水加热到90 ℃ B.向水中加少量NaOH溶液
C.向水中加少量Na2CO3溶液 D.向水中加少量FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质 :①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液
(1)属于电解质的是 ;(填序号)
(2)Ba(OH)2的电离方程式: ;
(3)写出NaHCO3溶液与NaOH溶液反应的离子方程式: ;
(4)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
(5)Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
①该Ba(OH)2溶液的物质的量浓度为___________________;
②溶液中由水电离出c(OH―)=______________;
③与某浓度HCl溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化肥厂用H2O、CO2、 NH3、CaSO4、制备(NH4)2SO4,工艺流程如下:
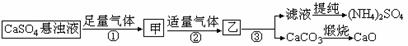
下列推断中正确的是( )
A.步骤①和②中的气体属于可循环使用的气体
B.步骤②中发生的反应为:Ca2++CO2+2NH3·H2O =CaCO3↓+2NH4++H2O
C.往甲中通CO2有利于(NH4)2SO4生成 D.以上涉及的化学反应中有氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com