
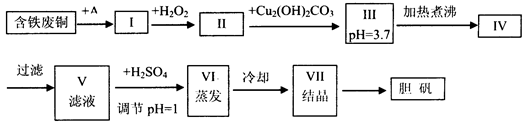
| 物质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
 Fe(OH)3↓+3H+;(2分)(5)抑制Cu2+的水解;(2分 )产生污染环境的二氧化硫,硫酸利用率低;(2分) 加热,并在稀硫酸中通入氧气。(注:本题为发散性试题,如有其它合理答案,酌情给分)(2分)
Fe(OH)3↓+3H+;(2分)(5)抑制Cu2+的水解;(2分 )产生污染环境的二氧化硫,硫酸利用率低;(2分) 加热,并在稀硫酸中通入氧气。(注:本题为发散性试题,如有其它合理答案,酌情给分)(2分) Fe(OH)3↓+3H+;
Fe(OH)3↓+3H+;

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:不详 题型:单选题
A.溶液中存在电离平衡:(NH4)2SO4 2NH4+ + SO42- 2NH4+ + SO42- |
| B.向溶液中滴加少量浓硫酸,c(NH4+)与c(SO42-)均增大 |
| C.加水稀释,溶液中所有离子的浓度均减小 |
| D.溶液中:c(SO42-)=2c(NH4+) + 2c(NH3·H2O) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入苯酚显紫色的溶液中:K+、NH、C1-、I- |
| B.Kw/c(H+)="0.2" mol/L的溶液中:Na+、I-、S2-、CO32- |
| C.使甲基橙变红的溶液中:CH3CHO、Na+、Cr2O72-、SO42- |
| D.0.1 mol/L NaAlO2溶液中:Al3+、Cu2+、SO32-、MnO4- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。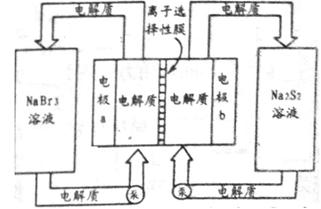
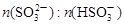 关系如下表:
关系如下表: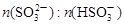 | 91∶9 | 1∶1 | 9∶91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Hg(l) + H2SO4(aq) = HgSO4(aq) + H2(g)常温下不能自发进行,说明△H<0 |
| B.用惰性电极电解1L1mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 molCu(OH)2固体可将溶液恢复至原浓度 |
| C.已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 |
| D.25℃时,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | HX | YOH | 溶液体积 | 粒子浓度 |
| ① | 强酸 | 强碱 | V(HX)=" V" (YOH) | c(HX) + c(X-) = c(Y+) |
| ② | 弱酸 | 弱碱 | V(HX)<V(YOH) | c(X-) < c(Y+) |
| ③ | 强酸 | 强碱 | V(HX)= V(YOH) | c(H+)>c(YOH) + c(OH-) |
| ④ | 弱酸 | 弱碱 | V(HX)>V(YOH) | c(Y+) + c(H+) = c(X-) + c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K+、Cl-、Na+、SO32- | B.Ba2+、NO3-、Al3+、Br- |
| C.K+、NH4+、I-、CO32- | D.Na+、Cu2+、NH3·H2O、SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+、Na+、SO42-、Cl- |
| B.H+、Fe2+、Cl-、NO3- |
| C.Ag+、Na+、CO32-、NO3- |
| D.Al3+、K+、Cl-、AlO2- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ca(OH)2的溶解度、溶剂的质量 | B.溶液中溶质的质量分数 |
| C.溶液的质量、水的电离平衡 | D.溶液中Ca2+的数目 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com