
【题目】工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)CH3OH(g). 
(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况.从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=
(2)图2表示该反应进行过程中能量的变化.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.该反应是(选填“吸热”或“放热”)反应,写出反应的热化学方程式 .
(3)该反应平衡常数K为 , 温度升高,平衡常数K(填“增大”、“不变”或“减小”).
(4)恒容条件下,下列措施中能使 ![]() 增大的有 .
增大的有 .
a.升高温度 b.充入He气
c.再充入2molH2 d.使用催化剂.
【答案】
(1)0.075mol?L﹣1?min﹣1
(2)放热;CO(g)+2H2(g)=CH3OH(g)△H=﹣91kJ?mol﹣1
(3)12;减小
(4)c
【解析】解:(1)v(CO)= ![]() =0.075 molL﹣1min﹣1 , 所以答案是:0.075 molL﹣1min﹣1;(2)由图可知,该反应中反应物的总能量大于生成物的总能量,故该反应为放热反应;
=0.075 molL﹣1min﹣1 , 所以答案是:0.075 molL﹣1min﹣1;(2)由图可知,该反应中反应物的总能量大于生成物的总能量,故该反应为放热反应;
由图可知,反应物为1molCO(g)和2molH2(g),生成物为1molCH3OH(g),△H=419﹣510=﹣91 kJmol﹣1 ,
故反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=﹣91 kJmol﹣1 ,
所以答案是:放热,CO(g)+2H2(g)=CH3OH(g)△H=﹣91 kJmol﹣1;(3)CO(g)+2H2(g)CH3OH(g)
开始(mol/L) 1 2 0
转化(mol/L) 0.75 1.5 0.75
平衡(mol/L) 0.25 0.5 0.75
则化学平衡常数K= ![]() =12;温度升高,平衡逆向移动,反应物的浓度增大,生成物的浓度减少,平衡常数减小;
=12;温度升高,平衡逆向移动,反应物的浓度增大,生成物的浓度减少,平衡常数减小;
所以答案是:12,减小;(4)a.该反应正反应是放热反应,升高温度平衡向逆反应移动,n(CH3OH)/n(CO)减小,故a错误;
b.充入He(g),使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,n(CH3OH)/n(CO)不变,故b错误;
c.再通入2molH2 , 平衡向正反应移动,n(CH3OH)/n(CO)增大,故c正确;
d.使用催化剂,平衡不移动,n(CH3OH)/n(CO)不变,故d错误,
所以答案是:c.
【考点精析】利用反应速率的定量表示方法和化学平衡常数的含义对题目进行判断即可得到答案,需要熟知反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t;指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是炼钢和炼铜的主要原料,在高温下灼烧生成三氧化二铁和氧化亚铜.三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某学校化学兴趣小组通过实验来探究﹣红色粉末是Fe2O3、Cu2O或两者的混合物,探究过程如下:[查阅资料]Cu2O溶于稀硫酸生成Cu和CuSO4 , 在空气中加热生成CuO.
[提出假设]假设1:红色粉末是Fe2O3 .
假设2:红色粉末是Cu2O.
假设3:红色粉末是Fe2O3和Cu2O的混合物.
[提出探究实验]取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂.
(1)若假设1成立,则实验现象是 .
(2)滴加KSCN试剂后溶液不变红色,某同学认为原固体粉末中一定不含三氧化二铁,你认为这种说法合理吗? . 简述你的理由(不需要写出反应的化学方程式) .
(3)若固体粉末完全溶液无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是 , 写出发生的氧化还原反应的离子方程式: .
(4)[探究延伸]经试验分析,确定红色粉末为Fe2O3和Cu2O的混合物.实验小组称取3.04g该红色粉末,设计如下实验方案进行实验.经查资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时的pH | 6.0 | 7.5 | 1.4 |
沉淀完全时的pH | 13 | 14 | 3.7 |
步骤Ⅰ:将3.04g红色粉末溶于足量稀硫酸中,再加入足量H2O2溶液,振荡,得澄清透明溶液X.
步骤Ⅱ:在溶液X中加入适量Cu(OH)2粉末,调节溶液pH=4.0,过滤,得红褐色沉淀Y和滤液Z.
步骤Ⅲ:将沉淀Y充分灼烧,得1.6g红色固体M.
步骤Ⅳ:将滤液Z蒸发浓缩,冷却结晶,过滤,得6.0gCuSO45H2O晶体.
①沉淀Y的化学式为 .
②步骤Ⅳ中不需要用到的实验仪器 .
a.烧杯b.玻璃棒c.分液漏斗d.酒精灯e.铁架台(带铁圈)f.托盘天平g.量筒h.蒸发皿i.容量瓶.
③红色粉末样品中Cu2O的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量(%)的影响如下图1:
CO(g)+3H2(g)。已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量(%)的影响如下图1:

图1(水碳比为3) 图2(800℃)
(1)CH4(g)+H2O(g)![]() CO(g)+3H2(g) 的△H_______0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将_____________移动(填“向正应方向”、“向逆反应方向”或“不”)。
CO(g)+3H2(g) 的△H_______0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将_____________移动(填“向正应方向”、“向逆反应方向”或“不”)。
(2)温度对该反应的反应速率和平衡移动的影响是_______________________。
(3)其他条件不变,请在图2中画出压强为2 MPa时,甲烷平衡含量(%)与水碳比之间关系曲线___________。(只要求画出大致的变化曲线)
(4)已知:在700℃,1MPa时,1mol CH4与1mol H2O在2L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少________?(写出计算过程,结果保留小数点后一位数字。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下海带提碘的实验方案可以缩短实验时间,避免Cl2和CCl4的毒性.其实验流程如下: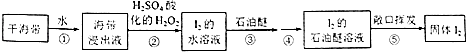
回答下列问题:
(1)步骤①的操作名称是;所需玻璃仪器有玻璃棒、烧杯和 .
(2)步骤②中加入H2O2后发生反应的化学方程式为;选择用H2O2做氧化剂的原因是 .
(3)检验I2的水溶液中含有单质碘的方法是,取样于试管中,加入淀粉,如溶液显色,则可证明含有碘单质.
(4)步骤③的操作名称是;石油醚能用作萃取剂,说明石油醚具有的性质是 .
(5)步骤⑤通过敞口挥发就能得到固体碘,说明石油醚具有良好的 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“爆竹声中一岁除,春风送暖入屠苏”是北宋文学家王安石的诗句。下列有关叙述错误的是( )
A.燃放爆竹既有噪音污染,又有有害气体与粉尘污染
B.屠苏酒中含乙醇,乙醇能发生取代反应
C.爆竹爆炸过程中发生了氧化还原反应
D.传统爆炸粉为黑火药,其主要成分为木炭、硫、KClO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列材料说法不正确是( )
序号 | 材料 | 类别 | 性能 | 用途 |
A | 钛合金 | 金属材料 | 密度小,强度高 | 制飞机机翼 |
B | 普通玻璃 | 硅酸盐材料 | 熔点高,透明 | 制试管、烧杯 |
C | 压电陶瓷 | 半导体材料 | 具有压电效应 | 声纳、地震仪 |
D | 氮化硅陶瓷 | 新型无机非金属材料 | 硬度高,耐磨 | 制发动机 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 ![]() 可简写为
可简写为 ![]() .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: 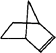
(1)降冰片烯属于 . A 环烃 B 不饱和烃 C 烷烃 D 芳香烃
(2)降冰片烯的分子式为 .
(3)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为 .
(4)降冰片烯不具有的性质 . A 能溶于水 B 能发生氧化反应
C 能发生加成反应 D 常温常压下为气体.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿浆(主费成分是MnO2)吸收工业要气中的SO2,并制备硫酸锰的生产流程如下(浸出液的pH<2,其中除含Mn2+外。还含有少量Fe2+、Al3+、Ca2+等金属离子):
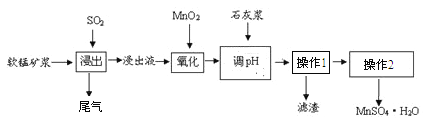
操作1的滤液通过阳离子吸附剂除去Ca2+。金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
请回答下列问题:
(1)浸出过程中被氧化的物质的化学式为____________________________。
(2)氧化过程中主要反应的离子方程式_________________________________。
(3)在氧化后的液体中加入石灰浆调节pH,pH的范围是_____________________。
(4)操作1的名称是________,操作2包括蒸发浓缩、______过滤、洗涤、干燥等操作。
(5)为测定所得MnSO4·H2O的纯度,准确称取上述样品1.720g加入适量H2SO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+后,配成200mL溶液。取20.00mL该溶液,向其中逐滴加入0.0500mol/L的FeSO4溶液,发生如下反应:Fe2++Mn3+=Fe3++Mn2+。当反应恰好完全进行时,共消耗FeSO4溶液19.50mL。通过计算确定MnSO4·H2O的纯度(写出计算过程)_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com