
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g) ![]() H2NCOONH4(s) △H=-272KJ·mol-1
H2NCOONH4(s) △H=-272KJ·mol-1
第二步:H2NCOONH4(s) ![]() CO(NH2)2(s)+H2O(g) △H=+138kJ·mol-1
CO(NH2)2(s)+H2O(g) △H=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:______________________。
(2)一定温度下,向2L恒容密闭容器中通入2molCO和1mol SO2,发生反应2CO(g)+SO2(g) ![]() 2CO2(g)+S(s)。若反应进行到20min时达平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=_________,该温度下反应化学平衡常数K=__________。
2CO2(g)+S(s)。若反应进行到20min时达平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=_________,该温度下反应化学平衡常数K=__________。

(3)工业上可用NaC1O碱性溶液或“亚硫酸盐法”吸收SO2。
①为了提高吸收效率,常用Ni2O3作为催化剂。催化过程如图所示:
a.过程2的离子方程式_______________________________。
b.Ca(C1O)2也可用于脱硫,且脱硫效果比NaC1O更好,原因是________________。
②室温条件下,将烟气通入(NH4)2SO4溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示,b点时溶液pH=7,则n(NH4+):n(SO32-)=__________。
(4)用食盐水做电解液电解烟气脱氮的原理如图,NO被阳极产生的氧化性物质氧化为NO3-,尾气经氢氧化钠溶液吸收后排入空气。如下图,电流密度和溶液pH对烟气脱硝的影响。

①NO被阳极产生的氧化性物质氧化为NO3-反应的离子方程式___________________。
②溶液的pH对NO去除率影响的原因是______________________。
【答案】2NH3(g)+CO2(g)![]() H2O(g)+CO(NH2)2(s) ΔH=-134kJ/mol 0.03mol·L-1·min-1 11.25 2NiO2+ClO-=Ni2O3+Cl-+2O Ca2+与SO42-结合生成难微溶的CaSO4,有利于反应的进行 3:1 3Cl2+8OH-+2NO=2NO3-+6Cl-+4H2O 次氯酸钠在酸性条件下氧化性增强
H2O(g)+CO(NH2)2(s) ΔH=-134kJ/mol 0.03mol·L-1·min-1 11.25 2NiO2+ClO-=Ni2O3+Cl-+2O Ca2+与SO42-结合生成难微溶的CaSO4,有利于反应的进行 3:1 3Cl2+8OH-+2NO=2NO3-+6Cl-+4H2O 次氯酸钠在酸性条件下氧化性增强
【解析】
(1)根据盖斯定律得出氨气和二氧化碳合成尿素的热化学方程式;
(2)利用化学平衡“三段式”计算CO的反应速率和反应的平衡常数;
(3)①过程2中NiO2和ClO-反应生成Ni2O3、Cl-、O;Ca(C1O)2也可用于脱硫,且脱硫效果比NaC1O更好,是因为Ca2+与SO42-结合生成微溶的CaSO4,有利于反应的进行;
②a点时,n(HSO3-):n(H2SO3)=1:1,b点时溶液的pH=7,根据电荷守恒可知:n(NH4+)= n(HSO3-)+2n(SO32-),又根据图像可知,n(HSO3-)=n(SO32-),n(NH4+):n(SO32-)=(1+2):1=3:1;
(4)①电解食盐水阳极产生氯气作氧化剂,NO为还原剂,在碱性条件下的反应为:3Cl2+8OH-+2NO=2NO3-+6Cl-+4H2O;
②次氯酸钠在酸性条件下氧化性增强,故控制电解液较低的pH有利于提高NO去除率。
(1)根据盖斯定律可知反应①+反应②即可得出氨气和二氧化碳合成尿素的热化学方程式为:2NH3(g)+CO2(g)![]() H2O(g)+CO(NH2)2(s) ΔH=-134kJ/mol,
H2O(g)+CO(NH2)2(s) ΔH=-134kJ/mol,
故答案为:2NH3(g)+CO2(g)![]() H2O(g)+CO(NH2)2(s) ΔH=-134kJ/mol。
H2O(g)+CO(NH2)2(s) ΔH=-134kJ/mol。
(2)设参加反应的SO2的物质的量为xmol,则有
2CO(g)+SO2(g)![]() 2CO2(g)+S(s)
2CO2(g)+S(s)
初始状态(mol) 2 1
反应的量(mol) 2x x 2x
平衡状态(mol)(2-2x) (1-x) 2x
即2x/(2-2x+1-x+2x)=0.5,解得x=0.6,V(CO)=0.6×2/2×20=0.03mol·L-1·min-1;
C(CO)=(2-1.2)/2=0.4mol/L,c(SO2)=(1-0.6)/2=0.2mol/L,c(CO2)=1.2/2=0.6mol/L,该温度下反应平衡常数K=c2(CO2)/c2(CO)c(SO2)=0.62/0.42×0.2=11.25L·mol-1,
故答案为:0.03mol·L-1·min-1,11.25。
(3)①为了提高吸收效率,常用Ni2O3作为催化剂。根据催化过程的示意图可知,过程2中NiO2和ClO-反应生成Ni2O3、Cl-、O,离子方程式为:2NiO2+ClO-=Ni2O3+Cl-+2O,
Ca(C1O)2也可用于脱硫,且脱硫效果比NaC1O更好,是因为Ca2+与SO42-结合生成难溶的CaSO4,有利于反应的进行,
故案为:2NiO2+ClO-=Ni2O3+Cl-+2O;Ca2+与SO42-结合生成微溶的CaSO4,有利于反应的进行。
②a点时,n(HSO3-):n(H2SO3)=1:1,b点时溶液的pH=7,根据电荷守恒可知:n(NH4+)= n(HSO3-)+2n(SO32-),又根据图像可知,n(HSO3-)=n(SO32-),n(NH4+):n(SO32-)=(1+2):1=3:1,
故答案为:3:1。
(4)①电解食盐水阳极产生氯气作氧化剂,NO为还原剂,在碱性条件下的反应为:3Cl2+8OH-+2NO=2NO3-+6Cl-+4H2O;
故答案为:3Cl2+8OH-+2NO=2NO3-+6Cl-+4H2O。
②次氯酸钠在酸性条件下氧化性增强,故控制电解液较低的pH有利于提高NO去除率;
故答案为:次氯酸钠在酸性条件下氧化性增强。


科目:高中化学 来源: 题型:
【题目】一定条件下反应N2(g)+3H2(g) ![]() 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为
2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为
A.1.2mol/(L·min)B.1.8mol/(L·min)
C.0.6mol/(L·min)D.0.4mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是
A.1L 1mol·L-1的NaOH溶液中含有NA个氧原子
B.常温常压下,14gCO和N2混合气所含质子总数为7NA
C.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
D.标准状况下,11.2L氦气所含的原子数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气与适量氯气混合反应可生成NH4Cl(俗称脑砂)和一种无污染的气体。某学习小组利用下列装置模拟该反应,请回答相关问题。

(1)该实验中所需的氯气是用浓盐酸与MnO2反应制取。装置A中仪器X的名称为____;X中发生反应的离子方程式为_______。
(2)要得到干燥纯净的氯气,上述A、B、C装置的连接顺序依次为a→_____(用小写字母表示)。
(3)利用E装置,将适量氨气与氯气充分混合反应氨气应从_______(用小写字母表示)通入,反应的化学方程式为_______________;可能观察到的现象是___________。
(4)《唐本草》记载脑砂入药可以散瘀消肿,天然脑砂含少量NH4Cl,现取天然脑砂进行NH4Cl含量测定。准确称取一定质量脑砂,与足量的氧化铜混合,如下图所示进行实验。已知:2NH4Cl+3CuO=3Cu+N2+2HCl+3H2O 。
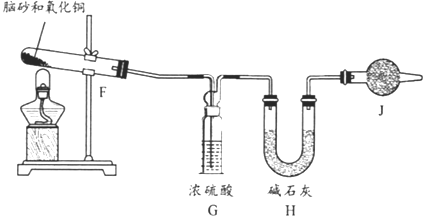
①为顺利完成有关物理量的测定,请完善下列表格:
测量时间点 | 加热前 | 当观察到_____现象时 |
测量内容 | _______________ | 停止加热,冷却,称量H装置的总质量 |
②如果不用J装置,测出NH4Cl的含量将_____(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 苯酚钠溶液中通入少量的二氧化碳,产物是苯酚和碳酸钠
B. 苯的同系物中,苯环和侧链相互影响,使得二者均易被氧化
C. ![]() 在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
D. 苯甲醛、苯乙烯分子中的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期(即原子序数为1~18号)元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上的电子数等于其内层电子数的差值 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下其单质为双原子分子,且占空气中的含量最大 |
Z | 该元素的某种含氧酸具有漂白性 |
(1)按要求用有关的化学用语填充:
T元素的离子符号:______;Y离子的电子式__________;Z离子的结构示意图_______________;
(2)元素Y与氢元素能形成一种10电子的阳离子,该微粒符号是____________;
(3)写出元素T的最高价含氧酸与X的最高价含氧酸对应的钠盐反应的化学方程式____
(4)元素Z与某一活泼金属元素组成的盐是重要的化工原料,写出其作为该原料在化工生产上电解的一个重要反应:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.煤的气化、煤的液化都是物理变化
B.石油是由多种烃组成的混合物
C.汽油都不能使溴水褪色
D.乙烷的产量可以衡量一个国家石油化工的发展水平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mLNa2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到14.51g白色沉淀,向白色沉淀中加入过量的稀HNO3,充分反应后,沉淀减少到4.66g,并有气体产生。
(1)原混合溶液中Na2SO4和Na2CO3的物质的量浓度各是______。
(2)产生的气体在标准状况下的体积是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.生产陶瓷的主要原料是石灰石和黏土
B.普通玻璃的主要成分只含有二氧化硅
C.二氧化硅可用来生产光纤
D.碳化硅又叫石英砂,可用作砂轮和砂纸的磨料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com