
| A. |  灼烧 | B. |  过滤 | ||
| C. |  分液 | D. |  蒸馏 |
分析 A.灼烧固体物质用坩埚;
B.过滤时需要玻璃棒引流;
C.碘在四氯化碳中的溶解度大于在水中的溶解度,且碘和四氯化碳不反应,水和四氯化碳不互溶,且四氯化碳密度大于水;
D.蒸馏时温度计测量馏分温度.
解答 解:A.灼烧固体物质用坩埚而不是蒸发皿,故A错误;
B.过滤时需要玻璃棒引流,否则易导致液体溅出或滤纸损坏,故B错误;
C.碘在四氯化碳中的溶解度大于在水中的溶解度,且碘和四氯化碳不反应,水和四氯化碳不互溶,所以可以用四氯化碳作萃取剂,四氯化碳密度大于水而在下层,水在上层,故C正确;
D.蒸馏时温度计测量馏分温度,所以温度计水银球应该位于蒸馏烧瓶支管口处,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,侧重考查基本操作及物质分离和提纯,明确实验原理及仪器的使用方法是解本题关键,注意萃取剂的选取方法、操作的规范性等,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 8个中子的碳原子的核素符号:12C | B. | 氢氧化钠的电子式: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | CH4分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
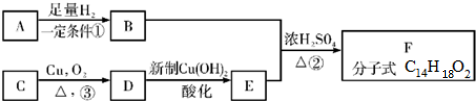
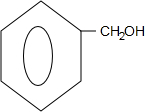 .
. +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$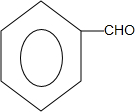 +2H2O;
+2H2O;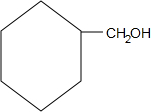 +
+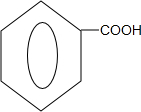 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$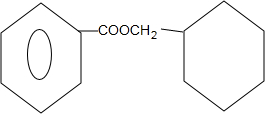 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑤⑥ | C. | ③ | D. | ②④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜作电极电解Na2SO4溶液:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$Cu2++H2↑ | |
| B. | NH4Al(SO4)2溶液与过量稀氨水反应:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 用稀硝酸清洗试管内壁的银镜:Ag+2H++NO3-=Ag++NO2↑+H2O | |
| D. | 过量氯气通入碘化亚铁溶液中:2Cl2+2Fe3++2I=4Cl-+2Fe3++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
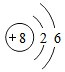 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com