
科目:高中化学 来源: 题型:阅读理解
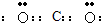
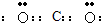


查看答案和解析>>
科目:高中化学 来源: 题型:
(13分)【化学一物质结构与性质】
A、B、M、X、Y、Z是元素周期表中的前20号元素.且原子序数依次增大。已知它们的部分化台物的性质如下表所示
| A的最简单氢化物 | B的最简单氢化物 | M的最简单氢化物 | X的氧化物 | Y的最简单氢化物 | Z的最高价氧化物 |
| 含氢量最高的有机物 | 水溶液呈碱性 | 水溶液呈酸性 | 两性氧化物 | 分子呈正四面体构型 | 对应水化物为最强酸 |
回答下列问题
(1)写出X原子的电子排布式 。
(2)A、B、M电负性由大到小的排列顺序为 。
(3)Y的最简单氢化物中,Y原子的杂化形式是 。
(4)B的最简单氢化物分子的空间构型是 ,属于 分子(填“极性”或“非极性”)。
(5)比较熔点高低:A最高价氧化物的熔点 Y最高价氧化物的熔点。
(6)判断沸点高低:M氢化物的沸点 Z氢化物的沸点,原因是 。
查看答案和解析>>
科目:高中化学 来源:2010年福建省厦门外国语学校高三模拟考试(理综)化学部分 题型:填空题
(13分)【化学一物质结构与性质】
A、B、M、X、Y、Z是元素周期表中的前 20号元素.且原子序数依次增大。已知它们的部分化台物的性质如下表所示
20号元素.且原子序数依次增大。已知它们的部分化台物的性质如下表所示
| A的最简单氢化物 | B的最简单氢化物 | M的最简单氢化物 | X的氧化物 | Y的最简单氢化物 | Z的最高价氧化物 |
| 含氢量最高的有机物 | 水溶液呈碱性 | 水溶液呈酸性 | 两性氧化物 | 分子呈正四面体构型 | 对应水化物为最强酸 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省高三“一诊”模拟考试(理综)化学部分 题型:填空题
A、Z、R、D、E、F、G是七种原子序数依次增大且不大于20的元素,其中有两种非金属元素位于同一土族。己知A、Z、D均能与R形成原子(或离子)个数不同的儿种常见化合物。请回答下列有关问题。
(1)若X、Y是D、F形成的最高价氧化物对应的水化物,浓度均为0.1mol/L的X、Y溶液的pH之和为14,则X、Y的晶体熔点相对高低为(写化学式) ,导致这种差异存在的原因是 在相同温度下,相等物质的量浓度的X、Y各自的溶液中,由水电离出的c(H+)的相对大小关系为 。
(2)A与Z、E均可形成正四面体构型的气态分子Q、P,又知P的燃烧热为1430kJ/mol.则其燃烧的热化学方程式 。
(3)R与D、F间;R与F、G间均可形成多种化合物,其中有两种是目前广泛使用的具有消毒杀菌能力的化合物。则相同物质的量浓度的这两种物质的溶液,消毒杀菌能力较强的物质的化学式为 ,另一种物质的溶液中,各离子浓度由大到小的顺序为 。
(4)上述七种元素间能形成多种常见二元化合物,其中Z与G形成的一种化合物存在两类化学键的物质溶于HC1溶液的化学反应方程式为 ,ZR2的电子式是 ,该分子的空间构型为 化合物ZRF2的结构式为____
(5)R能形成多种单质,如R2、R3,研究表明,新近制得的一种组成为R4的分子中,每个R原子均与另外两个R原子各形成一个键,则1molR4中共用电子对数为____NA,列有关R4的说法中正确的是
①R4与R3、R2互为同位素
②R4不能与A、Z、D的单质反应
③R4中各原予最外层均为8电子结构
④R4是1种新型化合物
查看答案和解析>>
科目:高中化学 来源:2010年福建省高三模拟考试(理综)化学部分 题型:填空题
(13分)【化学一物质结构与性质】
A、B、M、X、Y、Z是元素周期表中的前20号元素.且原子序数依次增大。已知它们的部分化台物的性质如下表所示
|
A的最简单氢化物 |
B的最简单氢化物 |
M的最简单氢化物 |
X的氧化物 |
Y的最简单氢化物 |
Z的最高价氧化物 |
|
含氢量最高的有机物 |
水溶液呈碱性 |
水溶液呈酸性 |
两性氧化物 |
分子呈正四面体构型 |
对应水化物为最强酸 |
回答下列问题
(1)写出X原子的电子排布式 。
(2)A、B、M电负性由大到小的排列顺序为 。
(3)Y的最简单氢化物中,Y原子的杂化形式是 。
(4)B的最简单氢化物分子的空间构型是 ,属于 分子(填“极性”或“非极性”)。
(5)比较熔点高低:A最高价氧化物的熔点 Y最高价氧化物的熔点。
(6)判断沸点高低:M氢化物的沸点 Z氢化物的沸点,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com