
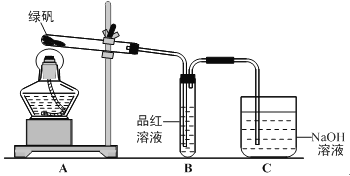
����Ŀ���ò���Fe3����FeSO4��Һ���ò���O2������ˮ���Ƶ�NaOH��Һ��Ӧ�Ʊ���ɫ��Fe(OH)2������
��1������������������������FeSO4��Һʱ�������ϡ�������м����д��������м��ԭ��___________��
��2����ȥ����ˮ���ܽ��O2�����õķ���___________��
��3�����ɰ�ɫFe ( OH )2�����IJ������ó��ι���ȡ����O2��NaOH��Һ������FeSO4��ҺҺ���£��ټ���NaOH��Һ�����������������ǣ�_________________��
��4�����и�ͼʾ���ܽϳ�ʱ�俴��Fe ( OH )2��ɫ��������_________(�����)��

���𰸡�
��1����ֹ�������ӱ����������������ӣ���2����У�
��3���������ɵ�Fe( OH )2�����Ӵ�O2����4���٢ڢ� ��
��������
�����������1������FeSO4�����ױ���������ˮ����ص㣬����������Һʱ�������ϡH2SO4��ֹ����ˮ�ⷴӦ��ͬʱ������м��ֹ�����������������ʴ�Ϊ����ֹ�������ӱ�������������������
��2������ˮ��������O2��������Fe(OH)2�����������������ܽ�����¶ȵ����߶���С����˿ɲ��ü�����еķ�����ȥ���ʴ�Ϊ��������У�
��3��Ϊ�������ɵ�Fe(OH)2�����Ӵ�O2�����ó��ι���ȡ����O2��NaOH��Һ������FeSO4��ҺҺ���£��ټ���NaOH��Һ���ɴﵽĿ�ģ��ʴ�Ϊ���������ɵ�Fe(OH)2�����Ӵ�O2����������
��4����Fe��ϡ���ᷴӦ���ɵ�������װ���ڿ����ų����ɷ�ֹ���ɵ���������������������ѡ����Fe��ϡ���ᷴӦ���ɵ�������װ���ڿ����ų���������������ѹ��ʹ����������NaOH�Ӵ�����Ӧ���ɷ�ֹ���ɵ���������������������ѡ����û�и������������ɵ������������ױ��������ʲ�ѡ�����������������ɷ�ֹ���ɵ���������������������ѡ���ʴ�Ϊ�٢ڢ� ��


 �γ̴����Ծ�����100��ϵ�д�
�γ̴����Ծ�����100��ϵ�д� �¾�����ĩ���100��ϵ�д�
�¾�����ĩ���100��ϵ�д� ȫ�ܴ���100��ϵ�д�
ȫ�ܴ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л������������ǣ��� ����
A. CH4 B. CCl4 C. C2H5OH D. CH3COOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. ʹ��ʳƷ���Ӽ����ᳫ����ɫʳƷ����Υ��
B. ����ʳƷ���Ӽ���ʳƷ������ʳ�ã��Է��ж�
C. ��ȻʳƷ���Ӽ������彡�������ʲ�����ʹ��
D. ʳƷ���Ӽ��ں���������Χ�ڲ�Ӱ�����彡��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ö�������ȡ��ϳɳ�һ�ֿ�������ҩ��.��ṹ��ʽ��ͼ��ʾ��

������������ȷ����
A�����������ڷ����廯����.������ˮ
B�������ʿ��Է����ӳ���������ȡ���ȷ�Ӧ
C������������ǿ���ǿ�_��Ӧ����������̼��������Ӧ
D�����ı������������ڱ����ϵ�λ�ã����ɵõ�10��ͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�������ᷢչϢϢ��ء�����˵������ȷ����
A. �����������Ѽ�·�������������γɵ����ܽ��ж����ЧӦ
B. ����������������֮�Ϊͭ�����ù��̷������û���Ӧ
C. ������һ�գ���ˮ�����գ���ȡ֭���������϶������ص���ȡ���ڻ�ѧ�仯
D. �Ž�����¬�����Լ���Ϊ�У�����Ϊ���ɣ�������������������ָ�������ĺϽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷���FeSO4��7H2O��������ԭ������ɫ������ҩ�ȣ��ڲ�ͬ�¶����ֽ�ø������������������������֪SO3��һ����ɫ���壬�۵�16.8�����е�44.8���������Լ���ˮ�Խ�Ũ����ǿ����Ư��ijЩ�л�Ⱦ�ϣ���Ʒ��ȡ��ش��������⣺
��1������ͬѧ������ͼ��ʾ��װ�ã�ͨ��ʵ������̷��ķֽ������װ��B�пɹ۲쵽�������� �������ɴ˵ó��̷��ķֽ�����к���SO2��װ��C�������� ��
��2������ͬѧ��Ϊ����ͬѧ��ʵ����۲��Ͻ�����Ϊ��Ҫ����ʵ�顣�ҶԼ���ͬѧ����ʵ���Bװ�õ��Թܼ��ȣ�������ɫ��Ʒ����Һδ�ָ���ɫ�����֤���̷��ֽ�IJ����� ��������ĸ��
A������SO2 B�����ܺ�SO2 C��һ������SO3
��3������ͬѧ�������Ϸ����̷����ȷֽ������O2�ų���Ϊ�ˣ�����ͬѧѡ�ü���ͬѧ�IJ���װ�ú���ͼ����װ����Ƴ���һ�����̷��ֽ���̬�����װ�ã�
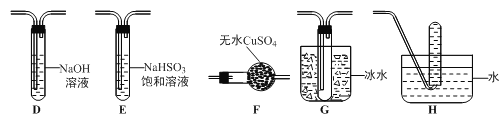
������ͬѧ��ʵ��װ���У��������ӵĺ���˳��Ϊ ��
����֤���̷��ֽ��������O2��ʵ������������� ��
��4��Ϊ֤���̷��ֽ�����к�����������ѡ�õ�ʵ���������Թܡ���ͷ�ιܡ� ��ѡ�õ��Լ�Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�������������ԭ�����͵��� �� ��
��ʢ��������������ƿ������ˮ����ɫ���� �����Ƶ���ˮ�ڹ�����������ɫ��dz ����H2��I2(g����HI��ɵ�ƽ����ϵ�У���ѹ�����������ɫ���� ������FeCl3��Һ�����ˮ�п��Ƶ������������� ��������أ�KMnO4����Һ��ˮϡ�ͺ���ɫ��dz ���Ӵ��������ڰ�������Ӧ ��500�����ұ����¸������ںϳɰ��ķ�Ӧ ���ռ��������ű���ʳ��ˮ�ķ��� ������Ũ��ˮ���������ƹ��������ȡ����
A���ڢۢݢ� B���ۢݢޢ� C���ۢݢޢ� D���ܢޢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������������ײʱ����ȫ�����з�����ӦNaN3+KNO3��K2O+Na2O+X����δ��ƽ������֪XΪ���ʣ��ڷ�Ӧ��NaN3ʧȥ���ӣ���÷�Ӧ��������Ϊ______��X�Ļ�ѧʽΪ______��
��2����ҵ����ȡ�ߴ���MnO2��ijһ������ͼ��ʾ��
![]()
��д���÷�Ӧ�����ӷ���ʽ__ ___��
��3������ƾ��壨CaC2O4H2O������������ϡ�н��������壮
����һ���¶�����2L���ܱ�����������������ƣ�������ռ������Բ��ƣ�������Ӧ��CaC2O4��s��CaO��s��+CO��g��+CO2��g������ǰ5min������CaO������Ϊ11.2g����ö�ʱ����v��CO��=__________molL��1min��1������Ӧ�ﵽƽ����������ѹ����ԭ����һ�룬������˵����ȷ����__________�����ѡ���ţ���
A��ƽ�ⲻ�ƶ���CaO����������
B��ƽ�ⷢ���ƶ�����CaC2O4�ķֽ�������
C��ƽ�ⷢ���ƶ�����CO��CO2��Ũ�ȶ�û�иı�
D��ƽ�����淴Ӧ�����ƶ����Ҹ÷�Ӧ�Ļ�ѧƽ�ⳣ����С
��ij�¶��£���0.3mol/L��Na2CO3��Һ�м�������CaC2O4��ĩ������Һ����仯������ֽ��裬������Ӧ��CO32����aq��+CaC2O4��s��CaCO3��s��+C2O42����aq�������ú����ת���ﵽƽ�⣮���ʱ��Һ�е�c��C2O42����= molL��1����֪�����¶��£�KSP��CaC2O4��=5.0��10��9��KSP��CaCO3��=2.5��10��9��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬ�¶��£�ˮ��Һ��c(H��)��c(OH��)����ͼ��ʾ��ϵ�����������������ӹ���˵������ȷ���ǣ� ��

A��a���Ӧ����Һ�д������ڣ�Fe3����Na����SCN����SO42��
B��b���Ӧ����Һ�д������ڣ�Na����Fe3����HCO3����I��
C��c���Ӧ����Һ�д������ڣ�Na����Ca2����Cl����CO32��
D��d���Ӧ����Һ�д������ڣ�Na����K����SO32����Cl��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com