
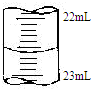
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
分析 (1)滴定终点为锥形瓶中的溶液从红色变为无色时,且半分钟内不变色,应停止滴定;
(2)滴定时眼睛应观察锥形瓶内溶液颜色的变化;
(3)用待测溶液润洗锥形瓶,会使的待测液的物质的量增多;根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析误差;
(4)酸式滴定管用蒸馏水洗净后,应用标准液润洗;
(5)根据滴定管的精确度为0.01mL读数;
(6)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$计算,V(标准)用两次的平均值.
解答 解:(1)当滴入最后一滴盐酸时,锥形瓶中的溶液从红色变为无色,且半分钟内不变色,达到终点,停止滴定,
故答案为:当滴入最后一滴盐酸时,锥形瓶中的溶液从红色变为无色,且半分钟内不变色;
(2)滴定时眼睛应观察锥形瓶内溶液颜色的变化,
故选答案为:B;
(3)待测溶液润洗锥形瓶,会使的待测液的物质的量增多,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,可知c(标准)偏大,使测定结果偏高,
故答案为:用待测溶液润洗锥形瓶;偏高;
(4)酸式滴定管用蒸馏水洗净后,应用标准液润洗,否则会使标准液浓度变稀,对测定结果有影响,
故答案为:酸式滴定管用蒸馏水洗净后,应用标准液润洗;
(5)滴定管中的液面读数为22.60mL,
故答案为:22.60;
(6)V(标准)=[(20.40-0.50)+(24.10-4.00)]mL÷2═20.00mL,c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$=$\frac{0.1000mol/L×20.00×1{0}^{-3}L}{25.00×1{0}^{-3}L}$=0.0800mol/L,
故答案为:0.0800.
点评 本题主要考查了中和滴定操作以及注意事项,难度中等,能用c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$准确分析实验误差和计算是解题关键.


科目:高中化学 来源: 题型:选择题
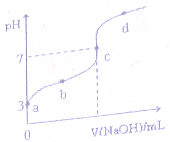 已知常温下CH3COOH的电离平衡常数为 k0,常温下,向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol.L-1NaOH溶液,其 pH变化曲线如图所示(忽略温度变化).下列说法正确的是( )
已知常温下CH3COOH的电离平衡常数为 k0,常温下,向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol.L-1NaOH溶液,其 pH变化曲线如图所示(忽略温度变化).下列说法正确的是( )| A. | a点表溶液中由水电离出的温度为1.0xl0-3mol•L-1 | |
| B. | b 点表示的溶液 c (CH3COO-)<c (Na+) | |
| C. | b、d点表示的溶液中$\frac{c(C{H}_{3}COO)•c({H}^{+})}{c(C{H}_{3}COOH)}$相等 | |
| D. | c点表示CH3COOH和NaOH恰好反应完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4 | B. | 稀HNO3 | C. | 盐酸 | D. | CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 )和抗癫痫药物H(
)和抗癫痫药物H(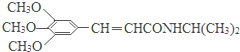 )的路线如图(部分反应略去条件和试剂):
)的路线如图(部分反应略去条件和试剂):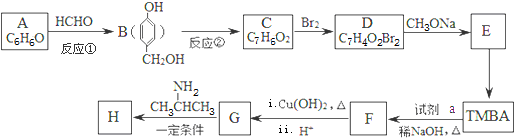
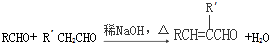 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)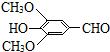 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O. +2Br2→
+2Br2→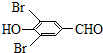 +2HBr.
+2HBr.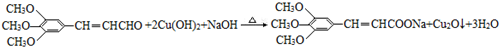 .
.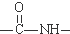 )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式 +NaOH→
+NaOH→ +H2NCH(CH3)2.
+H2NCH(CH3)2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
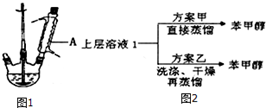 实验室以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸.反应式如下:
实验室以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸.反应式如下: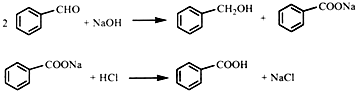
| 名称 | 分子量 | 性状 | 相对密度 (g•cm-3) | 熔点 (℃) | 沸点 (℃) | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 179.6 | 微溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 针状结晶 | 1.27 | 122.1 | 249 | 0.21g | 46.6g | 66g |
| 苯甲醇 | 108 | 无色液体 | 1.04 | -15.3 | 205.7 | 微溶 | 易溶 | 易溶 |
| 乙醚 | 74 | 无色液体 | 0.71 | -116.3 | 34.6 | 不溶 | 易溶 | 一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com