
 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题: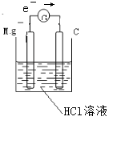 ,
, .
.


科目:高中化学 来源: 题型:
 磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.回答下列问题:
磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 -R
-R| KMnO4 |
| H+ |
 -COOH,从A出发,发生下列图示的一系列反应,其中W和Z互为同分异构体.
-COOH,从A出发,发生下列图示的一系列反应,其中W和Z互为同分异构体.
 互为同分异构体,属于酚类且苯环上只有两个互为对位取代基的化合物共有4种,其结构简式为:
互为同分异构体,属于酚类且苯环上只有两个互为对位取代基的化合物共有4种,其结构简式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.
如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
| ① | 10 | 15 | a | 10 | t1 |
| ② | 10 | 40 | 0 | 10 | t2 |
| ③ | 10 | b | 0 | 20 | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
| | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com