
| A. | NO2与于恒容容器中生成1molN2O4 | B. | NO2与于恒压容器中生成1molN2O4 | ||
| C. | N2O4与于恒容容器中生成1molNO2 | D. | N2O4与于恒压容器中生成1molNO2 |
科目:高中化学 来源: 题型:选择题
| A. | 将少量过氧化钠放入水中:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 硫酸溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 氯气与水反应:Cl2+H2O═Cl-+2H++ClO- | |
| D. | 硅酸钠溶液中通入过量CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加热浓氨水 | B. | 加热NH4Cl固体 | ||
| C. | 加热NH4Cl和Ca(OH)2的混合物 | D. | 加热小苏打固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
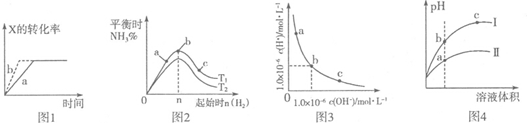
| A. | 图l所示,反应:X(g)+2Y(g)═3Z(g),b的压强一定比a大 | |
| B. | 图2表示合成氨反应,温度T1和T2对应的平衡常数为K1、K2,则:T1<T2,K1>K2 | |
| C. | 图3表明,该温度下,加入FeCl3不可能引起由b向a的变化 | |
| D. | 图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水的反应:2Na+2H+═2Na++H2↑ | |
| B. | 氯化铝溶液加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 铜与硝酸银溶液反应:Cu+Ag+═Ag+Cu2+ | |
| D. | 少量SO2通入NaOH溶液:SO2+2OH-═SO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com