
| A. | 准确量取20.00mL高锰酸钾溶液,可选用25 mL碱式滴定管 | |
| B. | 将水加热,Kw增大,pH不变 | |
| C. | 用惰性电极电解1 L浓度均为2 mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 mol电子转移时,阴极析出6.4g金属 | |
| D. | CuSO4 的水溶液经加热浓缩、蒸干灼烧后能得到CuSO4固体 |
分析 A、高锰酸钾溶液具有强氧化性能腐蚀碱式滴定管;
B、加热促进水的电离;
C、根据阳离子的放电顺序判断;
D、硫酸是不挥发的酸.
解答 解:A、高锰酸钾溶液具有强氧化性能腐蚀碱式滴定管,所以量取高锰酸钾溶液应该用酸式滴定管,故A错误;
B、加热促进水的电离,氢离子和氢氧根离子的浓度都增大,Kw增大,pH减小,故B错误;
C、Ag+氧化性大于Cu2+,1L浓度均为2mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2mol电子转移时,首先析出Ag,质量为0.2mol×108g/mol=21.6g,故C错误;
D、硫酸是不挥发的酸,所以CuSO4的水溶液经加热浓缩、蒸干灼烧后能得到CuSO4固体,故D正确;
故选D.
点评 本题考查了水的电离平衡、滴定管的使用、盐的水解等,侧重于基础知识的考查,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 该反应中Fe2+是还原剂,O2是还原产物 | |
| B. | 4 mol Na2O2在反应中共得到8NA个电子 | |
| C. | 每生成4 mol Fe(OH)3反应过程中共转移电子6 mol | |
| D. | 反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的pH=4 | |
| B. | 适当升高温度,溶液的pH不变 | |
| C. | 此酸的电离平衡常数约为1×10-7 | |
| D. | 由HX电离出的c(H+)约为水电离出的c(OH-)的106倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,物质的物质的量越大,体积也越大 | |
| B. | 同温同压下,气体的物质的量越大,体积也越大 | |
| C. | 同温同压下,同体积的气体具有相同的原子数 | |
| D. | 体积相同的气体,所含分子数也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 序号 | 实验步骤 | 预期现象 | 结论 |
| 1 | |||
| 2 | 锥形瓶中液体含大量Br- | ||
| 3 | 锥形瓶中液体含大量H+ |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
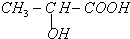 ,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2OH+HBr$→_{H+}^{△}$CH3CH2CH2Br+H2O | |
| B. |  +NaHCO3→ +NaHCO3→ +H2CO3 +H2CO3 | |
| C. |  +CO2+H2O→ +CO2+H2O→ +NaHCO3 +NaHCO3 | |
| D. |  +3Br2→ +3Br2→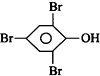 ↓+3HBr ↓+3HBr |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com